Go to English page
令和 5年 9月 26日
独立行政法人 医薬品医療機器総合機構
医薬品品質管理部
医薬品及び医薬部外品(以下「医薬品等」という。)外国製造業者に対するGMP適合性調査について (医薬品等外国製造業者向け説明)
はじめに
医薬品等外国製造業者に対するGMP適合性調査とは、独立行政法人医薬品医療機器総合機構(以下「PMDA」という。)が、当該製造所における製造管理及び品質管理の方法について、日本国のGMP(「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」:平成16年厚生労働省令第179号)に適合しているか否かを調査することであり、GMPに適合していることは製造販売承認の承認要件となる。
GMP適合性調査の種類
GMP適合性調査には、以下の種類がある。
申請に基づく調査
- 新規の製造販売承認申請時又は製造販売承認された事項の一部変更に係る承認申請時に行う適合性調査
- 承認後変更管理実施計画書(PACMP)の確認に伴う適合性確認(2021年8月より)
- 製造販売承認の取得後5年を経過するごとに行う定期の適合性調査
- 区分適合性
区分適合性は、製造工程の区分ごとに行う調査であり、製造業者に対し製造工程の区分ごとに3年間の有効期間を有する基準確認証が公布される。基準確認証の有効期間中は、その区分に属する品目は定期調査の省略が可能となる。この制度は、2021年8月に、国際整合の観点から導入したものである。
申請に基づかない調査
- 通常調査(PMDAがリスク評価に基づいて調査計画)
- 特別調査
調査対象となる製造所等
1. 「新規の製造販売承認申請時、製造販売承認された事項の一部変更に係る承認申請時もしくは変更計画確認を受けようとするときに行うGMP適合性調査」の場合
GMP適合性調査の対象製造所等は、製造販売承認申請書又は製造販売承認事項一部変更承認申請書に記載のある製造所のうち、審査においてGMP適合性調査が必要と判断された製造所及び外部試験検査機関である。なお、以下の製造所については、GMP適合性調査を受けることを要しない。
- 同一の品目又は同一の原薬について、既に適合性調査申請に基づく調査により適合性が確認されている場合であって、当該品目の適合性調査結果通知書の写し及び同一の品目であることを確認することのできる文書の写しを、承認申請品目の承認権者に提出する場合、それに該当する製造所又は外部試験検査機関
2. 「製造販売承認の取得後5年を経過するごとに行うGMP適合性調査」の場合
GMP適合性調査の対象製造所は、製造販売承認書に記載のある、全ての製造所(製剤、原薬、原薬中間体の製造所のほか、包装・表示・保管施設)である。なお、以下の製造所等については、GMP適合性調査を受けることを要しない。
- 製造所が当該品目について有効な基準確認証の交付を受けている場合。(ただし、新医薬品に係る初回の定期調査は、省略が出来ない。)
- 同一の原薬について、既に適合性調査申請に基づく調査により適合性が確認されている場合であって、当該品目の適合性調査結果通知書の写し及び同一の品目であることを確認することのできる文書の写しを、承認申請品目の承認権者に提出する場合、それに該当する製造所
- 外部試験検査機関
3. その他
一般用医薬品の原薬(新医薬品に該当するものを除く。)に係る製造所は適合性調査申請を要しない。
医薬品等外国製造業者に対するGMP適合性調査の流れ
-
医薬品等外国製造業者のGMP適合性調査申請は、製造販売承認申請を行う製造販売業者、外国特例承認取得者又は外国特例承認を取得しようとする者が、PMDAに対して行う。なお、外国特例承認を取得しようとする者が申請する場合は、製造販売業者を選任する必要がある。
-
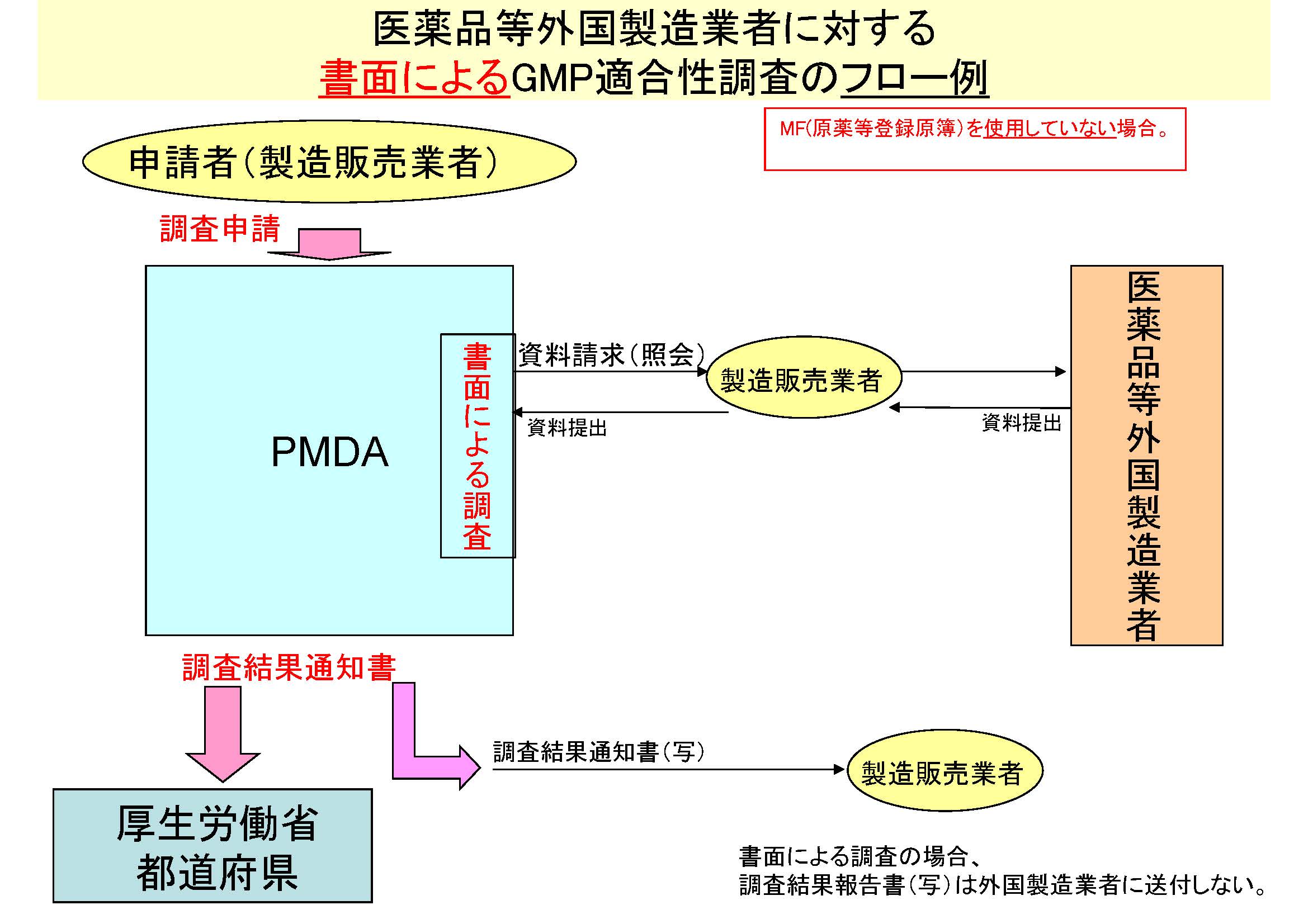
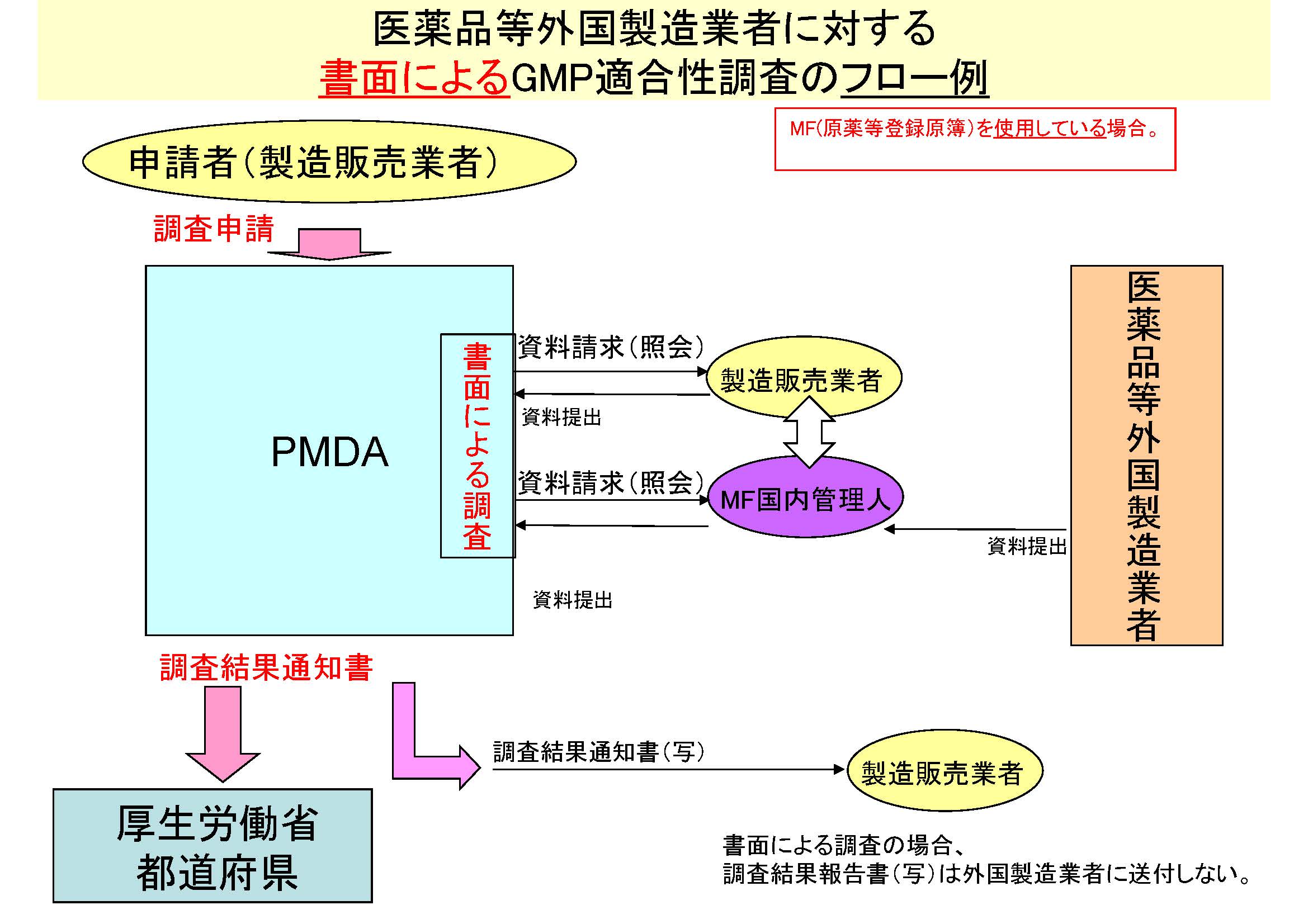
GMP適合性調査は実地調査(PMDAが現地で直接調査する。)によることが基本であるが、製品のリスク・当該国のGMP基準とその運用・提出された調査資料によるGMP遵守状況等を、PMDAが判断し、書面による調査が行われることもある。
-
調査結果については、PMDAは、厚生労働省及び調査を行った品目に係る製造販売業許可権者となる都道府県に「適合性調査結果通知書」により報告する。また、PMDAは、適合性調査申請した製造販売業者等に「適合性調査結果通知書」の写しを、実地による調査を実施した医薬品等外国製造業者に「調査結果報告書」の写しをそれぞれ発行する。ただし、書面による調査の場合には、「調査結果報告書」の写しは作成されない。
-
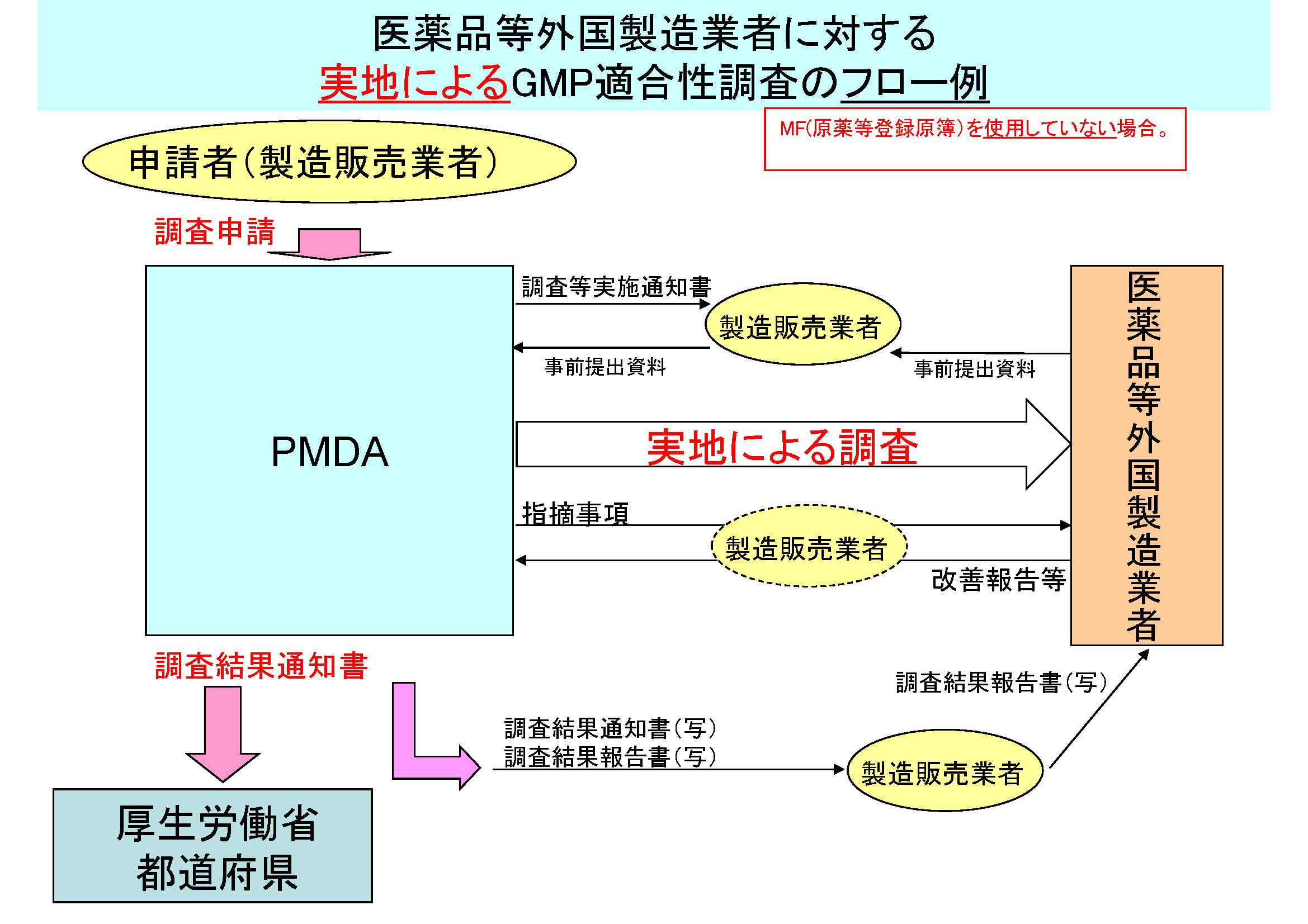
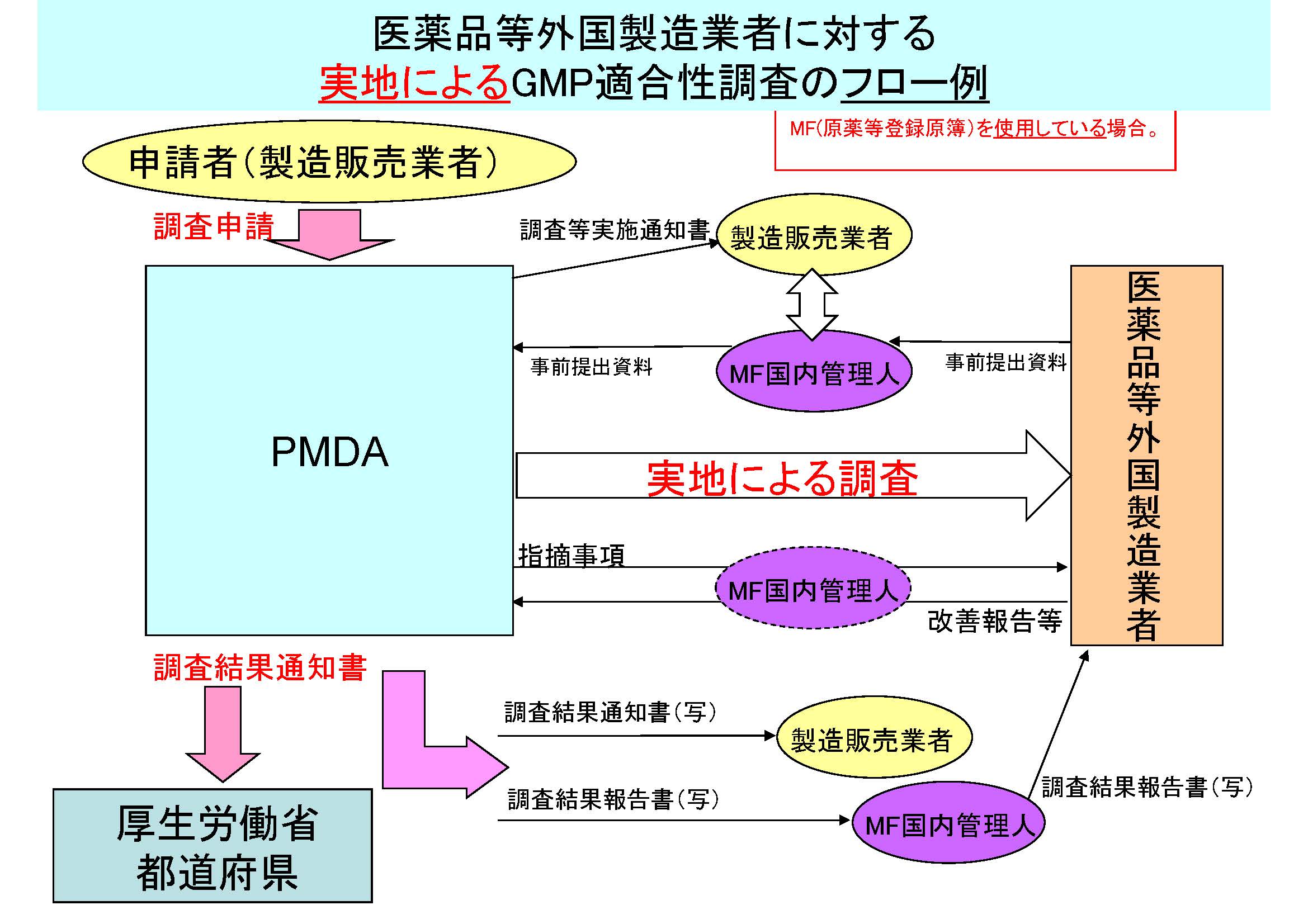
医薬品等外国製造業者に対するGMP適合性調査のフロー例を、以下に示す。
(注)MF(原薬等登録原簿)の使用の有無により、フローが異なるので留意すること。
実地によるGMP適合性調査のフロー例
MF(原薬等登録原簿)を使用していない場合
MF(原薬等登録原簿)を使用している場合
書面によるGMP適合性調査のフロー例
MF(原薬等登録原簿)を使用していない場合
MF(原薬等登録原簿)を使用している場合
調査申請時の添付資料
外国製造所に係る申請であっても、申請書及び添付資料は原則として日本語により作成する必要がある。なお、添付資料に限り、原文が外国語の資料が大部に及ぶ場合においては、主たる概要のみを日本語により作成することで差し支えない。
1.新規の製造販売承認申請時、製造販売承認された事項の一部変更に係る承認申請時もしくは変更計画確認を受けようとするときに行うGMP適合性調査の場合
-
当該適合性調査・確認申請の日から過去2年間に他の適合性調査権者等が実施したGMP調査に係る適合性調査結果通知書又は調査結果報告書の写し (調査が実施されている場合に限る。)
-
外国製造所に係る調査にあってはMRAを締結している国等に所在する製造所については当該MRAに基づく相手国の適合性証明書又はGMP調査報告書の写し等、MOU等の交換を行っている国等における製造所については当該MOU等に基づく相手国等の証明書又はGMP調査報告書の写し等、及びこれら以外の国等に所在する製造所についてはWHO証明書、その国等の当局による適合性証明書等
-
申請目の製造販売承認申請書等の写し
-
適合性調査権者が必要とする資料
提出資料の詳細は、事務連絡(A)(B)を参照。
2. 製造販売承認の取得後5年を経過するごとに行うGMP適合性調査の場合
-
当該適合性調査・確認申請の日から過去2年間に他の適合性調査権者等が実施したGMP調査に係る適合性調査結果通知書又は調査結果報告書の写し (調査が実施されている場合に限る。)
-
外国製造所に係る調査にあってはMRAを締結している国等に所在する製造所については当該MRAに基づく相手国の適合性証明書又はGMP調査報告書の写し等、MOU等の交換を行っている国等における製造所については当該MOU等に基づく相手国等の証明書又はGMP調査報告書の写し等、及びこれら以外の国等に所在する製造所についてはWHO証明書、その国等の当局による適合性証明書等
-
製造販売承認書の写し
-
過去5年間の一変承認書の写し
-
過去5年間の軽微な変更届書の写し
-
二以上の品目に係る申請を同時に行うときは、作業所、作業室、区域、設備等により分類し、その分類ごとに代表的な製品を選定し、その分類及び選定の根拠を示した資料(この規定により代表製品を選定した場合においては、a.からe. の資料は、当該代表製品に係るものに限定して差し支えない。)
-
過去5年間の申請品目に係る回収の有無(有の場合は、その概要)
-
宣誓書(様式は施行通知を参照。)
-
適合性調査権者が必要とする資料
提出資料の詳細は、事務連絡(A)を参照。
3. 区分適合性調査の場合
-
当該適合性調査・確認申請の日から過去2年間に他の適合性調査権者等が実施したGMP調査に係る適合性調査結果通知書又は調査結果報告書の写し (調査が実施されている場合に限る。)
-
外国製造所に係る調査にあってはMRAを締結している国等に所在する製造所については当該MRAに基づく相手国の適合性証明書又はGMP調査報告書の写し等、MOU等の交換を行っている国等における製造所については当該MOU等に基づく相手国等の証明書又はGMP調査報告書の写し等、及びこれら以外の国等に所在する製造所についてはWHO証明書、その国等の当局による適合性証明書等
-
申請に係る製造工程の区分で製造する品目のリスト(施行通知に記載されている品目リスト(別紙3-1)及び当該品目のリストに係る査察履歴(別紙3-2)
-
当該製造所の製品に起因する過去3年間の品目(日本向け以外のものも含む。) に係る回収等、 GMP 不適合、ワーニングレター、インポートアラート(海外規制当局によるものを含む。)等の有無 (有の場合は、その概要)
-
宣誓書(施行通知に記載されている宣誓書、別紙1-2)
-
サイトマスターファイル又は同等の資料
-
適合性調査権者が必要とする資料
提出資料の詳細は、事務連絡(A)を参照。
事務連絡(A)
「医薬品等適合性調査時の提出資料について」PMDA 医薬品品質管理部 2023年8月2日付
事務連絡(B)
「新規適合性調査申請に当たって提出すべき資料(適合性調査権者が必要とする資料)一覧」PMDA 医薬品品質管理部 2023年8月2日付
通知(C)
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の一部の施行に伴う政令、省令の制定及び改正について」 薬生監麻発0713第12号、2021年7月13日
参考情報
GMPが適用される医薬品
GMPが適用される医薬品は、次の a. から g. を除く医薬品となる。- 専らねずみ、ハエ、蚊、のみその他これらに類する生物の駆除又は防止のために使用されることが目的とされている医薬品のうち、人の身体に直接使用されることのないもの。
- 専ら殺菌又は消毒に使用されることが目的とされている医薬品のうち、人の身体に直接使用されることのないもの。
- 専らa. 又はb. に掲げる医薬品の製造の用に供されることが目的とされているAPIsたる医薬品。
- 生薬を粉末にし、又は刻む工程のみを行う製造所において製造される医薬品。
- 薬局製造販売医薬品。
- 医療の用に供するガス類のうち、(1)亜酸化窒素、(2)酸素、(3)窒素、(4)二酸化炭素、(5)亜酸化窒素及び酸素の混合物 g.a. から f. までに掲げるもののほか、日本薬局方に収められている物のうち、人体に対する作用が緩和なものとして厚生労働大臣が指定するもの。(アラビアゴム等110品目)
出典通知
- 「GMP 適合性調査申請の取扱いについて」薬生薬審発0713 第1号、薬生監麻発0713 第8号厚生労働省医薬食品局審査管理課長 厚生労働省医薬食品局監視指導・麻薬対策課長通知、2021年7月13日
- 「GMP 調査要領の制定について」薬生監麻発0728 第5号厚生労働省医薬・生活衛生局監視指導・麻薬対策課長通知、2022年3月17日
GMP調査結果報告書様式
報告年月日: 年 月 日
GMP調査結果報告書
(独) 医薬品医療機器総合機構理事長 殿
調査実施責任者
調査実施者
- 参照番号
- 一般的事項
- (1) 調査実施日(調査に要した時間を含む。)
- (2) 調査対象製造業者等の氏名(法人にあっては、名称)
- (3) 調査対象製造業者等の住所(法人にあっては、主たる事務所の所在地)
- (4) 調査対象製造所の名称
- (5) 調査対象製造所の所在地
- (6) 調査対象製造所に係る製造業者等の【許可・認定】の区分、番号及び年月日
- (7) 調査対象製造所で実施している活動(該当するもの全てに印)
□原薬製造、□最終製品製造、□中間製品(バルク製剤)製造、□小分け、包装、表示工
程、□外部試験検査機関、□市場への出荷判定、□その他( ) - (8)調査の範囲
- (9) 調査対象製造業者等の責任者の氏名、所属及び連絡先
- (10)前回調査結果等( 年 月 日実施)
- 調査内容
- (1) 調査目的
- (2) 調査の分類【適合性調査【実地・書面】・立入検査等】
- (3) 調査事項
- ① 製造所及び品目の概要
- ② 品質管理監督システム
- ③ 設備構造システム
- ④ 製品原材料等保管システム
- ⑤ 製造システム
- ⑥ 包装・表示システム
- ⑦ 試験室管理システム
- ⑧ 生物由来原料基準への対応状況
- ⑨ 承認申請書、MF記載内容との整合性
- 参考情報
- 指摘事項
- (1) 内容
- ① 重度の不備事項
- ② 中程度の不備事項
- ③ 軽度の不備事項
- (2) 措置及び改善結果確認
指摘事項書交付日:
改善計画/報告書受理日:- ① 重度の不備事項に対する改善計画/報告の内容
- ② 中程度の不備事項に対する改善計画/報告の内容
- ③ 軽度の不備事項に対する改善計画/報告の内容
- (1) 内容
- 総合判定:令和**年**月**日
(了)
