目次
(参考資料)
- 重篤副作用疾患別対応マニュアルについて
- 人工心肺装置の標準的接続方法およびそれに応じた安全教育等に関するガイドライン
この医薬品・医療機器等安全性情報は、厚生労働省において収集された副作用等の情報をもとに、医薬品・医療機器等のより安全な使用に役立てていただくために、医療関係者に対して情報提供されるものです。
平成19年(2007年)6月
厚生労働省医薬食品局
| No. | 医薬品等 | 対策 | 情報の概要 |
|---|---|---|---|
| 1 | UHF帯RFID機器及び新方式携帯電話端末の心臓ペースメーカ等の植込み型医療機器へ及ぼす影響について | 各種電波利用機器による植込み型医療機器への影響については、これまでも「医薬品・医療機器等安全性情報」により注意喚起を行ってきたところである。今般、総務省は新たにUHF帯RFID機器及び1.7GHz帯W-CDMA方式携帯電話端末から発射される電波に関する調査結果を受け、従来の「各種電波利用機器の電波が植込み型医療機器へ及ぼす影響を防止するための指針」を一部改正したため、本調査研究の内容を紹介するとともに、注意喚起を行うものである。 | |
| 2 | ガドジアミド水和物他(3件) | (使) (症) |
平成19年4月19日及び4月27日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について、改訂内容等とともに改訂の根拠となった症例の概要等に関する情報を紹介する。 |
| 3 | 使用上の注意の改訂について(その187) | ||
| 4 | 市販直後調査対象品目 | 平成19年6月1日現在、市販直後調査の対象品目一覧を紹介する。 |
(緊):緊急安全性情報の配布 (使):使用上の注意の改訂 (症):症例の紹介
|
厚生労働大臣への副作用等報告は、医薬関係者の業務です。 医師、歯科医師、薬剤師等の医薬関係者は、医薬品や医療機器による副作用、感染症、不具合を知ったときは、直接又は当該医薬品等の製造販売業者を通じて厚生労働大臣へ報告してください。なお、薬種商販売業や配置販売業の従事者も医薬関係者として、副作用等につき、報告することが求められています。 |
UHF帯RFID機器及び新方式携帯電話端末の心臓ペースメーカ等の植込み型医療機器へ及ぼす影響について
各種電波利用機器による植込み型心臓ペースメーカ及び植込み型除細動器(以下「植込み型医療機器」という。)への影響については、「医薬品・医療機器等安全性情報」のNo.136(平成8年3月号)、No.137(平成8年5月号)、No.143(平成9年6月号)、No.155(平成11年6月号)、No.173(平成14年1月号)、No.179(平成14年7月号)、No.190(平成15年6月号)、No.203(平成16年7月号)、No.216(平成17年8月号)及びNo.226(平成18年6月号)において累次、注意喚起を行ってきたところである。
総務省においては、平成12年度より「電波の医療機器等への影響に関する調査研究」を実施している。今般、総務省は新たにUHF帯RFID機器*1(ハンディタイプ、据置きタイプ及び機器内蔵タイプ)及び1.7GHz帯W-CDMA方式携帯電話端末から発射される電波が植込み型心臓ペースメーカ等の植込み型医療機器へ及ぼす影響について調査を行った。その結果、本年4月24日に「各種電波利用機器の電波が植込み型医療機器へ及ぼす影響を防止するための指針」(以下「指針」という。)を一部改正し、公表した。本稿においては、今般総務省が実施した調査研究の内容を紹介するとともに、その結果を踏まえ医療関係者を通じ植込み型医療機器装着者に対する注意喚起を行うこととした。
なお、総務省による今般の調査研究報告書等は総務省ホームページ「電波の医療機器等への影響に関する調査結果について[http://www.soumu.go.jp/s-news/2007/070424_5.html]」より閲覧できるので適宜参照されたい。
1.経緯
RFID機器及び携帯電話端末等から発射される電波が植込み型医療機器等に及ぼす影響については、これまで本誌において紹介をしてきたところである。RFID機器については、平成17年度にUHF帯の周波数を用いた機種の市場への投入が開始されており、携帯電話端末についても、前回調査が実施された平成17年度以降にも新方式や新機種が市場に投入されてきている。このような状況から、今般、総務省においてUHF帯RFID機器及び1.7GHz帯W-CDMA方式携帯電話端末から発射された電波が植込み型医療機器に及ぼす影響について調査研究を行い、その調査結果が公表されたことから、医療機関、医療従事者、医療機器業者等に対し紹介することとした。
2.調査概要
UHF帯RFID機器及び1.7GHz帯W-CDMA方式携帯電話端末の代表的機種*2から発射される電波が、現在使用されている植込み型医療機器の代表的機種*2へ及ぼす影響について、その影響が最も大きくなると考えられる実験条件を設定して調査が実施された。
(1)UHF帯RFID機器の電波が植込み型医療機器へ及ぼす影響
| (1) | 据置きタイプのRFID機器が植込み型医療機器へ及ぼす影響 | |
| ・ | 植込み型心臓ペースメーカ 据置きタイプのRFID機器のうち、「高出力型950MHz帯パッシブタグシステム*3」の一部の機器について、最大75cmの距離で「持続的な動悸、めまい等の原因になりうるが、その場から離れる等、患者自身の行動で原状を回復できるもの」とする可逆的な影響を生じる場合があることが確認された。 |
|
| ・ | 植込み型除細動器 最大10cmの距離で不要除細動ショック*4を生じる場合があることが確認された。 |
|
| (2) | ハンディタイプのRFID機器が植込み型医療機器へ及ぼす影響 | |
| 影響は確認されなかった。 | ||
| (3) | 機器内蔵タイプのRFID機器が植込み型医療機器へ及ぼす影響 | |
| 影響は確認されなかった。 | ||
(2)1.7GHz帯W-CDMA方式の携帯電話端末の電波が植込み型医療機器へ及ぼす影響
| ・ | 植込み型心臓ペースメーカ |
| 最大1cm未満の距離で影響を生じる場合があることが確認された。 | |
| ・ | 植込み型除細動器 |
| 影響は確認されなかった。 |
3.指針の改正概要
今般の電波の植込み型医療機器への影響に関する調査の結果に基づき、据置きタイプのRFID機器のうち、「高出力型950MHz帯パッシブタグシステム」から発射される電波により、植込み型心臓ペースメーカに影響が生じることがないようにするため、指針に以下の内容が追加された。
据置きタイプRFID機器(高出力型950MHz帯パッシブタグシステム)
|
4.医療関係者へのお願い
植込み型医療機器装着者に対して、今回の指針改正内容及び以下の注意事項について周知をお願いするとともに、患者が小児の場合には、保護者への指導の徹底も併せてお願いしたい。
●植込み型医療機器装着者に対する注意事項
(1)RFID機器について
(1)据置きタイプRFID機器(高出力型950MHz帯パッシブタグシステム機器に限る)
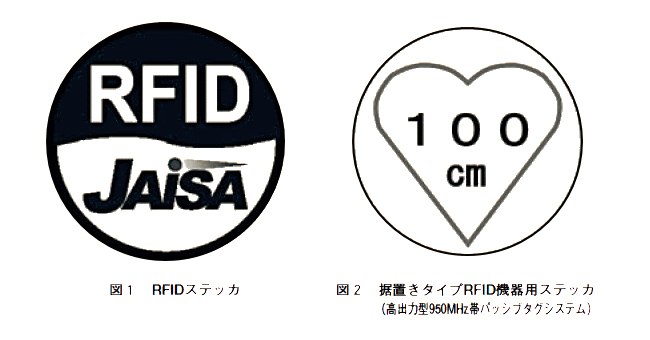
今回の指針改正では、新たにUHF帯RFID機器に関して「据置きタイプ高出力型950MHz帯RFID機器の半径1m以内には近づかないこと」とする内容が追加されている。本指針の改正は植込み型医療機器を通常の使用条件とは異なる最高感度に設定して得られた結果に基づいて行われたものであり、一般的な条件で使用されている植込み型医療機器において影響が認められた不具合事例はこれまで報告されていない。また、当該機器は、主に荷物の保管、構内作業、輸送に使用されるコンテナやパレットなどに貼付したタグの一括読み取りを目的としたものであるため、現状では倉庫などの限定された場所で使用されている。以上のことから、日常生活の上で直ちに影響を生じる可能性は極めて低いと考えられるが、予防的措置として図1及び図2のステッカが貼付されているRFID機器の周囲1m以内には近づかないよう注意をお願いしたい。なお、設置場所等の情報は、総務省[http://www.soumu.go.jp/]及び(社)日本自動認識システム協会(JAISA)のホームページ[http://www.jaisa.or.jp/]等を参照していただきたい。
また、該当するRFID機器の周囲において体調に何らかの変化を感じた場合は、担当の医師に相談するようお願いしたい。
| (2) | ハンディタイプ、据置きタイプ(高出力型950MHz帯パッシブタグシステムを除く)、及び機器内蔵タイプのRFID機器 |
平成17年度の調査結果によって示された指針に準じ、「植込み型心臓ペースメーカ等の装着部位から22cm程度以内に近づけないこと」とされているので、従来のRFID機器と同様の注意が必要である。
(2)携帯電話端末について
今般の調査研究による指針の改正はないため、引き続き現行指針(22cm)を守るよう注意をお願いしたい。
| 表1 今般の植込み型医療機器と各種電波利用機器に関する指針の改正概要 |
| 従来の指針 | 改正指針 | |||
| 携帯電話端末 | 22cm程度以上 離すこと |
(変更なし) | ||
| RFID機器(下記周波数帯以外のもの) | 22cm程度以内に 近づけないこと |
|||
| UHF帯RFID機器 | 据置きタイプ | 高出力型950MHz帯 パッシブタグシステム |
--- | 1m以内に 近づかないこと |
| 上記を除く | 22cm程度以内に 近づけないこと |
|||
| ハンディタイプ | ||||
| 機器内蔵タイプ | ||||
〈参考〉
| *1 | RFID(Radio Frequency Identification)機器:電子回路を内蔵したタグとリーダライタの間で非接触で通信を行うことによりタグのデータを読み書きすることが可能な機器であり、物流、在庫管理や商品等の精算など、様々な分野で利用されている。 また、リーダライタの形状から次のような種類がある。
|
||||||||||||||
| *2 | 調査で用いられた無線機器及び植込み型医療機器
|
||||||||||||||
| *3 | 高出力型950MHz帯パッシブタグシステム:比較的長距離の通信が可能なUHF帯(950MHz帯)の電波を利用するRFID機器。例えば、コンテナやパレットなどに貼付したタグの一括読み取り等のアプリケーションに使用されることが想定されている。 | ||||||||||||||
| *4 | 不要除細動ショック:心室細動がないにもかかわらず、植込み型除細動器の除細動機能が働く現象のこと。 |
5.その他
総務省より、平成18年度までに実施した調査の結果をもとに、平成19年4月付けで「各種電波利用機器の電波が植込み型医療機器へ及ぼす影響を防止するための指針」のとりまとめが別添のとおり公表されたので参考までに紹介する。
別添
各種電波利用機器の電波が植込み型医療機器へ及ぼす影響を防止するため の指針
平成19年4月
総 務 省
近年、携帯電話をはじめとする様々な無線システムが日常生活の中で重要な役割を果たすようになっており、電波を発射する機器が身近なところで利用される機会が増大しています。このような電波を発射する機器(ここでは「電波利用機器」といいます。)には、携帯電話端末のほかに、PHS端末、ワイヤレスカード(非接触ICカード)システム、電子商品監視(EAS)機器、RFID機器(電子タグの読み取り機)、無線LAN機器などが含まれますが、これらと電気・電子機器が近接すると、電波利用機器から発射される電波により電気・電子機器に誤動作等の影響が発生する場合があります。
電気・電子機器の中でも、体内に植え込んで使用する心臓ペースメーカ等の植込み型医療機器については、電波利用機器からの電波により誤動作が発生した場合に健康に悪影響が生じる可能性があることから、電波利用機器の利用者、植込み型医療機器の装着者、双方の機器の製造者等が影響の発生・防止に関する情報を共有し、影響の防止に努めていくことが重要です。
植込み型医療機器への影響の発生・防止に関する情報としては、平成9年に不要電波問題対策協議会(学識経験者、関係省庁、関係業界団体等から構成。現在の電波環境協議会。事務局:(社)電波産業会。)により、医療機関の医療電気機器をも対象とした「医用電気機器への電波の影響を防止するための携帯電話端末等の使用に関する指針」が策定されています。総務省では、その後、新たな方式による携帯電話端末が使用されるようになったこと、新たな電波利用機器の利用が拡大してきたことなどを踏まえ、各種の電波利用機器から発射される電波が植込み型医療機器へ及ぼす影響について調査を実施し、その結果を公表してきましたが、平成17年8月、平成16年度までに実施した調査の結果を基に、各種電波利用機器の電波が植込み型医療機器へ及ぼす影響を防止するための指針として取りまとめを行いました。その後、平成17年度に800MHz帯W-CDMA方式の携帯電話端末について、平成18年度に1.7GHz帯W-CDMA方式の携帯電話端末とUHF帯RFID機器についての調査を実施し、その結果を踏まえて、指針の見直しを行いました。
調査に当たっては、関係団体等の協力を得て、調査時点において市場に出回っている代表的な機種を網羅するように調査対象を選定しましたが、市場に出回っているすべての機種を調査対象としたわけではなく、調査後に新たな機種が市場に出されることなどもあります。また、専門家により妥当と認められる方法により試験を行っていますが、あらゆる環境条件等を考慮しているわけではありません。このため、指針の活用に当たっては、このような点を十分に考慮する必要があります。
総務省では、安全で安心な電波利用環境の整備・維持のため、今後必要に応じてこの指針の見直しを行っていきます。電波利用機器の利用者や植込み型医療機器の装着者は、この指針やその他の有益な情報を参考にして影響の防止に努めることが重要です。また、電波利用機器や植込み型医療機器の製造者等は、必要以上に強い電波を発射しない機器の開発・製造や電波の影響を排除する能力の高い機器の開発・製造などにより影響の防止に努めることが重要です。さらに、関係者は、影響の防止のために有益な情報の周知などを行い、情報の共有に努めることが重要です。
|
|
|
|
| 注: | 本指針の対象としているワイヤレスカード(非接触ICカード)システムとは、外部の読み取り装置(リーダライタ部)とこれが発信する弱い電波を利用してデータを送受信するICカードからなるもので、各種交通機関や入退出管理等で用いられている。 |
|
| ア | 植込み型医療機器の装着者は、EAS機器が設置されている場所及びEASステッカ(下図)が貼付されている場所では、立ち止まらず通路の中央をまっすぐに通過すること。 |
| イ | 植込み型医療機器の装着者は、EAS機器の周囲に留まらず、また、寄りかかったりしないこと。 |
| ウ | 植込み型医療機器の装着者は、体調に何らかの変化があると感じた場合は、担当医師に相談すること。 |
| エ | 植込み型医療機器に対するEAS機器の影響を軽減するため、更なる安全性の検討を関係団体で行っていくこと。 |

図 EASステッカ
| 注: | 本指針の対象としている電子商品監視(EAS)機器とは、感知ラベルやタグを貼り付けた商品がレジカウンターで精算されずにこの機器のセンサーを通過したときに警報音を発することにより商品の不正持出しを防止する機器のことである。 |
※ 図のEASステッカは、日本EAS機器協議会の許諾を得て使用しています。
|
(1)ゲートタイプRFID機器(注2)
| ア | 植込み型医療機器の装着者は、ゲートタイプRFID機器が設置されている場所及びRFIDステッカ(図1)が貼付されている場所では、立ち止まらずに通路の中央をまっすぐに通過すること。 |
| イ | 植込み型医療機器の装着者は、ゲートタイプRFID機器の周囲に留まらず、また、寄りかかったりしないこと。 |
| ウ | 植込み型医療機器の装着者は、体調に何らかの変化があると感じた場合は、担当医師に相談すること。 |
| エ | 植込み型医療機器に対するゲートタイプRFID機器の影響を軽減するため、更なる安全性の検討を関係団体で行っていくこと。 |
(2) 据置きタイプRFID機器(注2)(高出力型950MHz帯パッシブタグシステム(注3)に限る。以下(2)において同じ。)
| ア | 植込み型医療機器の装着者は、据置きタイプRFID機器が設置されている場所及びRFIDステッカ(図1と図2のステッカを組み合わせたもの。)が貼付されている場所の半径1m以内には近づかないこと。 |
| イ | 植込み型医療機器の装着者は、体調に何らかの変化があると感じた場合は、担当医に相談すること。 |
| ウ | 植込み型医療機器に対する据置きタイプRFID機器の影響を軽減するため、更なる安全性の検討を関係団体で行っていくこと。 |
(3) ハンディタイプ、据置きタイプ(高出力型950MHz帯パッシブタグシステムを除く。以下(3)において同じ。)及びモジュールタイプのRFID機器(注2)
| ア | ハンディタイプRFID機器の操作者は、ハンディタイプRFID機器のアンテナ部を植込み型医療機器の装着部位より22cm程度以内に近づけないこと。 |
| イ | 植込み型医療機器の装着者は、装着部位を据置きタイプ及びモジュールタイプのRFID機器のアンテナ部より22cm程度以内に近づけないこと。 |
| ウ | 植込み型医療機器に対するハンディタイプ、据置きタイプ及びモジュールタイプのRFID機器の影響を軽減するため、更なる安全性の検討を関係団体で行っていくこと。 |

図1 RFIDステッカ
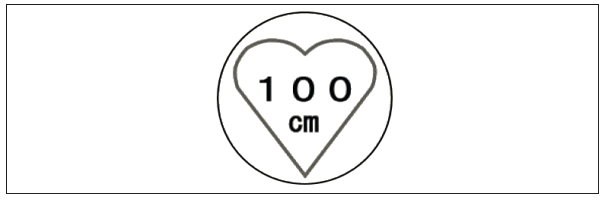
図2 据置きタイプRFID機器(高出力型950MHz帯パッシブタグシステム)用ステッカ
| 注1: | ここでは、公共施設や商業区域などの一般環境下で使用されるRFID機器を対象としており、工場内など一般人が入ることができない管理区域でのみ使用されるRFID機器(管理区域専用RFID機器)については対象外としている。なお、管理区域専用RFID機器については、(社)日本自動認識システム協会において、一般環境への流出を防止するため、取扱説明書等に注意書きを記載するとともに、管理区域専用RFID機器用ステッカ(図3)を貼付することとされている。 |

図3 管理区域専用RFID機器用ステッカ
| 注2: | ここでは、RFID機器をリーダライタの形状から次のように分類している。
|
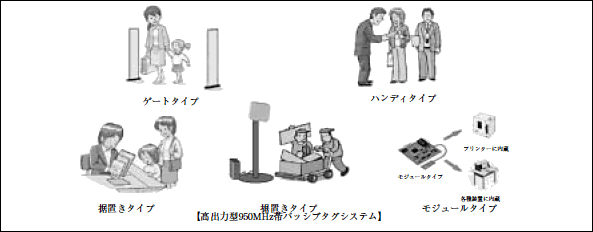
図4 各タイプのRFID機器
| 注3: | 比較的長距離の通信が可能なUHF帯(950MHz帯)の電波を利用するRFID機器。 例えば、コンテナやパレットなどに貼付したタグの一括読み取り等のアプリケーションに使用されることが想定される。 |
| ※ | 図1及び図3のRFIDステッカは、(社)日本自動認識システム協会の許諾を得て使用しています。 また、図2の据置きタイプRFID機器(高出力型950MHz帯パッシブタグシステム)用ステッカは、ペースメーカ協議会の許諾を得て使用しています。 |
|
無線LAN機器によって影響を受けた植込み型医療機器は、1機種であったことから、厚生労働省の協力を得て、医療機関を通じ同機種の利用者全員に対して、試験結果に基づく注意喚起が行われている。
よって、現時点で特段の注意をされていない植込み型医療機器の装着者は、無線LAN機器に対しては特別の注意は必要としない。
重要な副作用等に関する情報
平成19年4月19日及び4月27日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について、改訂内容等とともに改訂の根拠となった症例の概要等に関する情報を紹介いたします。
【1】ガドジアミド水和物
| 販売名(会社名) | オムニスキャン、同シリンジ (第一三共) |
| 薬効分類等 | その他の診断用薬 |
| 効能効果 | 磁気共鳴コンピューター断層撮影における下記造影。 ○脳・脊髄造影 ○躯幹部・四肢造影 |
| 《使用上の注意(下線部追加改訂部分)》 | ||
| [原則禁忌] |
|
|
| [副作用 (重大な副作用)] |
腎性全身性線維症(Nephrogenic Systemic Fibrosis、NSF):重篤な腎障害のある患者において、腎性全身性線維症があらわれることがあるので、投与後も観察を十分に行い、皮膚のそう痒、腫脹、硬化、関節の硬直、筋力低下等の異常の発生には十分留意すること。 | |
| 〈参 考〉 | 直近約3年間(平成16年4月1日~平成19年3月31日)の副作用報告(因果関係が否定できないもの)の件数 ・腎性全身性線維症:1例(うち死亡0例) 関係企業が推計したおおよその年間使用者数:約50万人(平成18年4月~平成19年3月) 販売開始:平成8年6月 |
|
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 男 20代 |
MRI造影検査 (慢性腎不全、脊髄馬尾神経鞘腫術後、てんかん、C型肝炎、甲状腺乳頭癌、心房細動、被嚢性腹膜硬化症) |
10mL 1回 |
腎性全身性線維症 腹膜透析施行患者、甲状腺機能は正常、C型肝炎はPCRでウイルス陰性維持を確認。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
臨床検査値
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 併用薬:リシノプリル、クロナゼパム、パンコール・B2・B6・ニコチン酸アミド配合剤、アルファカルシドール、ベシル酸アムロジピン、硫酸鉄、プレドニゾロン、ファモチジン | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
【2】カベルゴリン
| 販売名(会社名) | カバサール錠0.25mg、同錠1.0mg(ファイザー) |
| 薬効分類等 | 抗パーキンソン剤 |
| 効能効果 | パーキンソン病 乳汁漏出症 高プロラクチン血性排卵障害 高プロラクチン血性下垂体腺腫(外科的処置を必要としない場合に限る) 産褥性乳汁分泌抑制 |
| 《使用上の注意(下線部追加改訂部分)》 | |||||||||
| [禁 忌] |
|
||||||||
| [効能又は効果に関連 する使用上の注意] |
パーキンソン病治療において、非麦角製剤の治療効果が不十分又は忍容性に問題があると考えられる患者のみに投与すること。〔「重要な基本的注意」及び「副作用」の項参照〕 | ||||||||
| [重要な基本 的注意] |
|
||||||||
| [副作用 (重大な副作用)] |
胸膜炎、胸水、胸膜線維症、肺線維症、心膜炎、心嚢液貯留:胸膜炎、胸水、心嚢液貯留があらわれることがある。また、本剤の長期投与又はドパミン受容体刺激作用を有する麦角製剤の治療歴のある患者に本剤を投与した場合、胸膜線維症、肺線維症、心膜炎があらわれることがある。本剤の投与中に胸痛、浮腫、呼吸器症状等があらわれた場合には、速やかに胸部X線検査を実施し、異常が認められた場合には投与を中止し、適切な処置を行うこと。 心臓弁膜症:十分な観察(聴診等の身体所見、胸部X線、CT等)を定期的に行い、心雑音の発現又は増悪等があらわれた場合には、速やかに胸部X線検査、心エコー検査等を実施すること。心臓弁尖肥厚、心臓弁可動制限及びこれらに伴う狭窄等の心臓弁膜の病変が認められた場合には投与を中止し、適切な処置を行うこと。 後腹膜線維症:後腹膜線維症が報告されているので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。 |
||||||||
| 〈参 考〉 | 直近約3年間(平成16年4月1日~平成19年3月31日)の副作用報告(因果関係が否定できないもの)の件数
販売開始:平成11年8月 |
||||||||
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||
| 1 | 男 70代 |
パーキンソン病 (高血圧、胆石症) |
2mg 910日間 |
胸膜炎 既往歴:舌の悪性新生物、胃癌
|
||||||||||||||
| 併用薬:塩酸セレギリン、レボドパ・カルビドパ、ウルソデオキシコール酸、アテノロール、ベシル酸アムロジピン | ||||||||||||||||||
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||||||
| 2 | 男 70代 |
パーキンソン病(便秘) | 0.25mg 7日間 ↓ 0.5mg 21日間 ↓ 1mg 14日間 ↓ 2mg 82日間 |
心嚢液貯留 既往歴:胆石症、胆嚢切除
|
||||||||||||||||||||||||
| 併用薬:なし | ||||||||||||||||||||||||||||
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||
| 3 | 女 60代 |
パーキンソン病 (睡眠時無呼吸症候群、高コレステロール血症) |
4mg 1554日間 |
心臓弁膜症(疑)
|
||||||||||||||||
| 併用薬:レボドパ・塩酸ベンセラジド、塩酸アマンタジン、塩酸セレギリン、アトルバスタチンカルシウム水和物、メシル酸ペルゴリド | ||||||||||||||||||||
【3】メシル酸ペルゴリド
| 販売名(会社名) | ペルマックス錠50μg、同錠250μg(日本イーライリリー) ベセラール錠50μg、同錠250μg(大洋薬品工業) ペルゴリド錠50μg「サワイ」、同錠250μg「サワイ」(メディサ新薬) ペルゴリン顆粒0.025%(ダイト) メシル酸ペルゴリド錠50μg「アメル」、同錠250μg「アメル」(共和薬品工業) メシル酸ペルゴリド錠50μg「メルク」、同錠250μg「メルク」(メルク製薬) |
| 薬効分類等 | 抗パーキンソン剤 |
| 効能効果 | パーキンソン病 |
| 《使用上の注意(下線部追加改訂部分)》 | |||||
| [禁 忌] |
|
||||
| [効能又は効果に関連 する使用上の注意] |
非麦角製剤の治療効果が不十分又は忍容性に問題があると考えられる患者のみに投与すること。〔「重要な基本的注意」及び「副作用」の項参照〕 | ||||
| [重要な基本 的注意] |
非麦角製剤と比較して、本剤を含む麦角製剤投与中の心臓弁膜症、線維症の報告が多いので、パーキンソン病に対する薬物療法について十分な知識・経験を持つ医師のもとで本剤の投与を開始するとともに、投与継続中はリスクとベネフィットを考慮すること。〔「副作用」の項参照〕 本剤の長期投与において心臓弁膜症があらわれることがあるので、投与前・投与中に以下の検査を行い、十分な観察を行うこと。なお、投与中止により改善がみられたとの報告例もある。
|
||||
| [副作用 (重大な副作用)] |
心臓弁膜症:十分な観察(聴診等の身体所見、胸部X線、CT等)を定期的に行い、心雑音の発現又は増悪等があらわれた場合には、速やかに胸部X線検査、心エコー検査等を実施すること。心臓弁尖肥厚、心臓弁可動制限及びこれらに伴う狭窄等の心臓弁膜の病変が認められた場合には投与を中止し、適切な処置を行うこと。 | ||||
| 〈参 考〉 | 直近約3年間(平成16年4月1日~平成19年3月31日)の副作用報告(因果関係が否定できないもの)の件数
販売開始:平成6年8月 |
||||
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||
| 1 | 男 60代 |
パーキンソン病[軽症] (高血圧、高脂血症) |
250μg 約1ヵ月間 ↓ 1000μg 約6ヵ月間 ↓ 750μg 約15ヵ月間 ↓ 1000μg 約1ヵ月間 ↓ 1250μg 約3ヵ月間 ↓ 1000μg 約5ヵ月間 ↓ 750μg 約1ヵ月間 ↓ 450μg 3日間 ↓ 300μg 3日間 ↓ 150μg 3日間 ↓ 100μg 3日間 |
心弁膜疾患
|
||||||||||||||||||||
| 併用薬:カベルゴリン、レボドパ・塩酸ベンセラジド、塩酸アマンタジン、メシル酸ブロモクリプチン、塩酸セレギリン、フロセミド、メチルジゴキシン、ワルファリンカリウム、スピロノラクトン、酸化マグネシウム | ||||||||||||||||||||||||
【4】リスペリドン
| 販売名(会社名) | リスパダール細粒1%、同錠1mg、同錠2mg、同錠3mg、同内用液1mg/mL(ヤンセンファーマ) |
| 薬効分類等 | 精神神経用剤 |
| 効能効果 | 統合失調症 |
| 《使用上の注意(下線部追加改訂部分)》 | |||
| [重要な基本 的注意] |
本剤の投与により、高血糖や糖尿病の悪化があらわれ、糖尿病性ケトアシドーシス、糖尿病性昏睡に至ることがあるので、本剤投与中は、口渇、多飲、多尿、頻尿等の症状の発現に注意するとともに、特に糖尿病又はその既往歴あるいはその危険因子を有する患者については、血糖値の測定等の観察を十分に行うこと。 本剤の投与に際し、あらかじめ上記の副作用が発現する場合があることを、患者及びその家族に十分に説明し、口渇、多飲、多尿、頻尿等の異常に注意し、このような症状があらわれた場合には、直ちに投与を中断し、医師の診察を受けるよう、指導すること。 |
||
| [副作用 (重大な副作用)] |
高血糖、糖尿病性ケトアシドーシス、糖尿病性昏睡:高血糖や糖尿病の悪化があらわれ、糖尿病性ケトアシドーシス、糖尿病性昏睡に至ることがある。口渇、多飲、多尿、頻尿等の症状の発現に注意するとともに、血糖値の測定を行うなど十分な観察を行い、異常が認められた場合には、投与を中止し、インスリン製剤の投与等の適切な処置を行うこと。 | ||
| 〈参 考〉 | 直近約3年間(平成16年4月1日~平成19年3月8日)の副作用報告(因果関係が否定できないもの)の件数
販売開始:平成8年6月 |
||
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||
| 1 | 女 40代 |
統合失調症 (糖尿病、バセドウ病) |
3mg 127日間 |
糖尿病性ケトアシドーシス
|
||||||||||||||
|
||||||||||||||||||
| 併用薬:マレイン酸レボメプロマジン、塩酸トリヘキシフェニジル、塩酸ビペリデン、ジアゼパム、タカヂアスターゼ・生薬配合剤、酸化マグネシウム、プロトポルフィリンナトリウム | ||||||||||||||||||
使用上の注意の改訂について(その187)
(1)医薬品等
平成19年4月27日に改訂を指導した医薬品の使用上の注意(本号の「2重要な副作用等に関する情報」で紹介したものを除く。)について、改訂内容、主な該当販売名等をお知らせいたします。
| 1 | 〈解熱鎮痛消炎剤〉 アンピロキシカム |
|
| [販売名] | フルカムカプセル 13.5mg、同カプセル 27mg(ファイザー)他 |
| [副作用 (重大な副作用)] |
肝機能障害、黄疸:AST(GOT)・ALT(GPT)の上昇等を伴う肝機能障害、黄疸があらわれることがあるので、定期的に肝機能検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。 |
| 2 | 〈解熱鎮痛消炎剤〉 ピロキシカム(経口剤、坐剤) |
|
| [販売名] | バキソカプセル10、同カプセル20 、同坐剤(富山化学工業)、フェルデンサポジトリ (ファイザー)他 |
| [副作用 (重大な副作用)] |
肝機能障害、黄疸:AST(GOT)・ALT(GPT)の上昇等を伴う肝機能障害、黄疸があらわれることがあるので、定期的に肝機能検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。 |
| 3 | 〈血管拡張剤〉 ニソルジピン |
|
| [販売名] | バイミカード錠5mg、同錠10mg(バイエル薬品)他 | |
| [禁 忌] |
|
|
| [相互作用 (併用禁忌)] |
|
| 4 | 〈気管支拡張剤〉 テオフィリン(徐放性経口剤)、(小児の用法・用量を有する製剤) |
|
| [販売名] | テオドールG20%、同錠50mg、同錠100mg、同シロップ2%、同ドライシロップ20%(三菱ウェルファーマ)他 |
| [効能・効果に関連 する使用上の注意] |
喘息性(様)気管支炎:発熱を伴うことが多く、他の治療薬による治療の優先を考慮すること(テオフィリン投与中に発現した痙攣の報告は、発熱した乳幼児に多い)。 |
| 5 | 〈その他の腫瘍用薬〉 オキサリプラチン |
|
| [販売名] | エルプラット注射用100mg(ヤクルト本社) |
| [副作用 (重大な副作用)] |
急性腎不全:間質性腎炎、尿細管壊死等により、急性腎不全等の重篤な腎障害があらわれることがあるので、観察を十分に行い、腎機能検査値(BUN、血清クレアチニン値等)に異常が認められた場合には投与を中止し、適切な処置を行うこと。 |
| 6 | 〈その他の腫瘍用薬〉 三酸化ヒ素 |
|
| [販売名] | トリセノックス注10mg(日本新薬) |
| [副作用 (重大な副作用)] |
汎血球減少、無顆粒球症、白血球減少、血小板減少:汎血球減少、無顆粒球症、白血球減少、血小板減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。 |
| 7 | 〈その他の化学療法剤〉 ミコナゾール |
|
| [販売名] | フロリードF注、同F点滴静注用0.267%、同ゲル経口用(持田製薬)他 | |
| [禁 忌] |
|
|
| [相互作用 (併用禁忌)] |
|
| 8 | 〈駆虫剤〉 イベルメクチン |
|
| [販売名] | ストロメクトール錠3mg(萬有製薬) |
| [副作用 (重大な副作用)] |
中毒性表皮壊死症(Lyell症候群)、皮膚粘膜眼症候群(Stevens-Johnson症候群):中毒性表皮壊死症(Lyell症候群)、皮膚粘膜眼症候群(Stevens-Johnson症候群)があらわれることがあるので観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。 |
(2)医療機器
平成19年4月27日に改訂を指導した医療機器の使用上の注意について、改訂内容等をお知らせいたします。
| 1 | 人工心肺装置を構成する人工肺、血液ポンプ、血液回路等の医療機器 | |
| [使用上の注意] | 本医療機器を用いた体外循環回路の接続・使用に当たっては、学会のガイドライン等、最新の情報を参考とすること。
|
市販直後調査の対象品目一覧
| (平成19年6月1日現在) |
| 一般名 | 製造販売業者名 | 市販直後調査開始年月日 |
| 販売名 | ||
| イトラコナゾール | ヤンセンファーマ(株) | 平成18年12月6日 |
| イトリゾール注1% | ||
| ロピニロール塩酸塩 | グラクソ・スミスクライン(株) | 平成18年12月6日 |
| レキップ錠0.25mg、同錠1mg、同錠2mg | ||
| ランソプラゾール | 武田薬品工業(株) | 平成18年12月7日 |
| タケプロン静注用30mg | ||
| ロサルタンカリウム・ヒドロクロロチアジド | 萬有製薬(株) | 平成18年12月8日 |
| プレミネント錠 | ||
| ポリドカノール | 堺化学工業(株) | 平成18年12月14日 |
| ポリドカスクレロール0.5%注2mL、同1%注2mL、同3%注2mL | ||
| 塩酸フェキソフェナジン | サノフィ・アベンティス(株) | 平成19年1月9日 |
| アレグラ錠30mg | ||
| ペルフルブタン | 第一三共(株) | 平成19年1月10日 |
| ソナゾイド注射用 | ||
| ペメトレキセドナトリウム水和物 | 日本イーライリリー(株) | 平成19年1月22日 |
| アリムタ注射用500mg | ||
| レミフェンタニル塩酸塩 | ヤンセンファーマ(株) | 平成19年1月22日 |
| アルチバ静注用2mg、同静注用5mg | ||
| インフリキシマブ(遺伝子組換え) | 田辺製薬(株) | 平成19年1月26日 |
| レミケード点滴静注用100*1 | ||
| ザナミビル水和物 | グラクソ・スミスクライン(株) | 平成19年1月26日 |
| リレンザ*2 | ||
| タクロリムス水和物 | アステラス製薬(株) | 平成19年1月26日 |
| プログラフカプセル0.5mg、同カプセル1mg*3 | ||
| バクロフェン | 第一三共(株) | 平成19年1月26日 |
| ギャバロン髄注0.005%、同髄注0.05%、同髄注0.2%*4 | ||
| ミカファンギンナトリウム | アステラス製薬(株) | 平成19年1月26日 |
| ファンガード点滴用25mg、同点滴用50mg、同点滴用75mg*5 | ||
| ルリオクトコグアルファ(遺伝子組換え) | バクスター(株) | 平成19年2月22日 |
| アドベイト注射用 250、同注射用 500、同注射用1000 | ||
| フォリトロピンベータ(遺伝子組換え) | 日本オルガノン(株) | 平成19年3月16日 |
| フォリスチム注50、同注75*6 | ||
| ペグインターフェロンアルファ-2a(遺伝子組換え) | 中外製薬(株) | 平成19年3月16日 |
| ペガシス皮下注90μg、同皮下注180μg*7 | ||
| リバビリン | 中外製薬(株) | 平成19年3月16日 |
| コペガス錠200mg | ||
| モダフィニル | アルフレッサファーマ(株) | 平成19年3月28日 |
| モディオダール錠100mg | ||
| 塩酸バラシクロビル | グラクソ・スミスクライン(株) | 平成19年4月18日 |
| バルトレックス顆粒50%*8 | ||
| エンタカポン | ノバルティスファーマ(株) | 平成19年4月19日 |
| コムタン錠100mg |
| *1: | 効能追加された「ベーチェット病による難治性網膜ぶどう膜炎(既存治療で効果不十分な場合に限る)」 |
| *2: | 効能追加された「A型又はB型インフルエンザ感染症の予防」 |
| *3: | 効能追加された「ループス腎炎(ステロイド剤の投与が効果不十分、又は副作用により困難な場合)」 |
| *4: | 用法追加された「小児」 |
| *5: | 効能追加された「造血幹細胞移植患者におけるアスペルギルス症及びカンジダ症の予防」 |
| *6: | 効能追加された「視床下部-下垂体機能障害に伴う無排卵及び希発排卵における排卵誘発」 |
| *7: | 効能追加された「リバビリンとの併用による以下のいずれかのC型慢性肝炎におけるウイルス血症の改善(1)セログループ1(ジェノタイプI(1a)又はII(1b))でHCV-RNA量が高値の患者(2)インターフェロン単独療法で無効又はインターフェロン単独療法後再燃した患者」 |
| *8: | 効能追加された「水痘」 |
参考資料1
重篤副作用疾患別対応マニュアルについて
重篤副作用疾患別対応マニュアルについては、「医薬品・医療機器等安全性情報」のNo.230(2006年11月号)において紹介したところであるが、今般、第2弾として「薬剤性過敏症症候群」、「急性腎不全」、「血小板減少症」等の副作用疾患のマニュアルを取りまとめ、厚生労働省ホームページ(http://www.mhlw.go.jp/)及び医薬品医療機器情報提供ホームページ(https://www.pmda.go.jp/)に掲載しました。
今回公表した重篤副作用疾患別対応マニュアル名と主な初期症状を表1に、重篤副作用疾患別対応マニュアル一覧を表2に示します。
医師、歯科医師、薬剤師等の医療関係者や患者の方々においては、本マニュアルをご活用いただき、重篤な副作用の早期発見・早期対応に努めていただければ幸いです。
表1 今回公表した重篤副作用疾患別対応マニュアル
| マニュアル名 | 主な初期症状 |
| 薬剤性過敏症症候群 | 「皮ふの広い範囲が赤くなる」、「高熱(38℃以上)」、「のどの痛み」、「全身がだるい」、「食欲が出ない」、「リンパ節がはれる」 |
| 急性腎不全 | 「尿量が少なくなる」、「ほとんど尿が出ない」、「一時的に尿量が多くなる」、「発疹」、「むくみ」、「体がだるい」 |
| 間質性腎炎(尿細管間質性腎炎) | 「発熱」、「発疹」、「関節の痛み」、「はき気、嘔吐、下痢、腹痛などの消化器症状」、「むくみ」、「尿量が少なくなる」 |
| 血小板減少症 | 「手足に点状出血」、「あおあざができやすい」、「出血しやすい(歯ぐきの出血・鼻血・生理が止まりにくい)」 |
| 血栓症(血栓塞栓症、塞栓症、梗塞) | 「手足のまひやしびれ」、「しゃべりにくい」、「胸の痛み」、「呼吸困難」、「片方の足の急激な痛みや腫れ」 |
| 出血傾向 | 「手足に点状出血」、「あおあざができやすい」、「鼻血」、「歯ぐきの出血」「便が黒くなる(タール便)」 |
| 播種性血管内凝固(全身性凝固亢進障害、消費性凝固障害) | 「あおあざができやすい」、「鼻血」、「歯ぐきの出血」、「血尿」、「鮮血便」、「目(結膜)の出血」、「意識障害」、「呼吸困難」、「どうき」、「息切れ」、「尿が出なくなる」、「黄疸」 |
| 薬剤性貧血(溶血性貧血、メトヘモグロビン血症、赤芽球ろう、鉄芽球性貧血、巨赤芽球性貧血) | 「顔色が悪い」、「疲れやすい」、「だるい」、「頭が重い」、「どうき」、「息切れ」 |
| 無顆粒球症(顆粒球減少症、好中球減少症) | 「突然の高熱」、「さむけ」、「のどの痛み」 |
| 再生不良性貧血(汎血球減少症) | 「あおあざができやすい」、「歯ぐきや鼻の粘膜からの出血」、「発熱」、「のどの痛み」、「皮膚や粘膜があおじろくみえる」、「疲労感」、「どうき」、「息切れ」、「気分が悪くなりくらっとする」、「血尿」 |
表2 重篤副作用疾患別対応マニュアル一覧(作成作業中のものも含む)
| 領域 | 学会名 | 対象副作用疾患 | ||||||||||||||||||
| 皮膚 | 日本皮膚科学会 |
|
||||||||||||||||||
| 肝臓 | 日本肝臓学会 |
|
||||||||||||||||||
| 腎臓 | 日本腎臓学会 |
|
||||||||||||||||||
| 血液 | 日本臨床血液学会 |
|
||||||||||||||||||
| 呼吸器 | 日本呼吸器学会 |
|
||||||||||||||||||
| 消化器 | 日本消化器病学会 |
|
||||||||||||||||||
| 心臓・循環器 | 日本循環器学会 |
|
||||||||||||||||||
| 神経・筋骨格系 | 日本神経学会 |
|
||||||||||||||||||
| 精神 | 日本臨床精神神経薬理学会 |
|
||||||||||||||||||
| 代謝・内分泌 | 日本内分泌学会 |
|
||||||||||||||||||
| 日本糖尿病学会 |
|
|||||||||||||||||||
| 過敏症 | 日本アレルギー学会 |
|
||||||||||||||||||
| 感覚器(眼) | 日本眼科学会 |
|
||||||||||||||||||
| 口腔 | 日本口腔外科学会 |
|
||||||||||||||||||
| 骨 | 日本口腔外科学会 |
|
||||||||||||||||||
| 日本整形外科学会 |
|
|||||||||||||||||||
| 泌尿器 | 日本泌尿器科学会 |
|
注)掲載済みのマニュアルには、「○」を付けている。
参考資料2
人工心肺装置の標準的接続方法およびそれに応じた
安全教育等に関するガイドライン
平成18年度医薬品等適正使用推進事業として、日本心臓血管外科学会、日本胸部外科学会、日本人工臓器学会、日本体外循環技術医学会、日本医療器材工業会の協力を得て、「人工心肺装置の標準的接続方法およびそれに応じた安全教育等に関するガイドライン」がまとまりましたので紹介します。
参考として、初期教育に用いる人工心肺装置の標準的接続方法等(3種類の回路の接続図及び確認事項)を掲載します。
 |
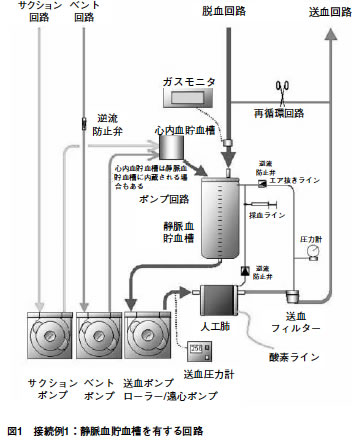
図1 | 接続例1: | 静脈血貯血槽を有する回路 | 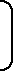 |
|
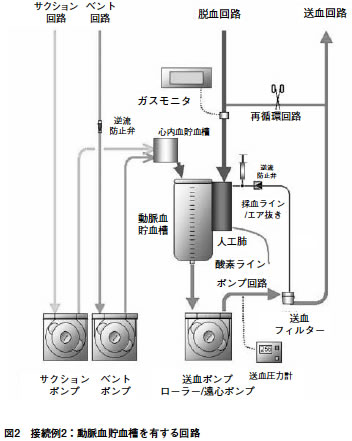
| 図2 | 接続例2: | 動脈血貯血槽を有する回路 | |||
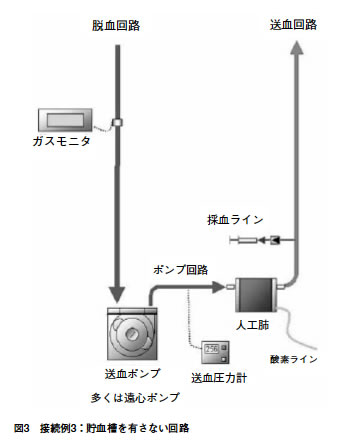
| 図3 | 接続例3: | 貯血槽を有さない回路 |
なお、当該ガイドラインについては、厚生労働省ホームページに全文を掲載しています(http://www.mhlw.go.jp/topics/2007/04/tp0427-10.html)。
| 委員長 | 許 俊 鋭 | 埼玉医科大学心臓血管外科 |
| 委員 | 四 津 良 平 | 慶應義塾大学心臓血管外科 |
| 同 | 冨 澤 康 子 | 東京女子医科大学心臓血管外科 |
| 同 | 林 裕 樹 | 名古屋医療センター臨床工学室 |
| 同 | 寺 井 大 輔 | テルモ株式会社 |
| 分担執筆 | 百 瀬 直 樹 | 自治医科大学大宮医療センター臨床工学部 |
| 同 | 又 吉 徹 | 慶應義塾大学医用工学センター |
| 同 | 関 口 敦 | 埼玉医科大学病院ME サービス部 |
| 同 | 吉 田 謙 | 埼玉医科大学病院ME サービス部 |
| 同 | 津 藤 保 | 泉工医科工業株式会社 |
| 協力 | 加藤木 利 行 | 埼玉医科大学心臓血管外科 |
| 同 | 安 達 秀 雄 | 自治医科大学附属大宮医療センター心臓血管外科 |
接続例1:静脈血貯血槽を有する回路
◎必須 ○推奨
脱血回路
| ◎ | 接続部では、脱血回路であることが判断できる手段を有すること。 |
| ◎ | 患者組織への十分な酸素供給を監視できる手段を有すること。 |
| ◎ | 補助脱血手段を用いて脱血を行う場合には、回路内圧を監視できる手段を有すること。 |
| ○ | 循環血液量の不足を迅速に補うための手段を有すること。 |
ポンプ回路
| ◎ | ポンプ出口の回路内圧を監視できる手段を有すること。 |
送血回路
| ◎ | 接続部では、送血回路であることが判断できる手段を有すること。 |
| ◎ | 気泡や異物を除去できる手段を有すること。 |
| ◎ | 気泡や異物を除去できる部品と接続される気泡除去ラインには逆流を防止する手段を有すること。 |
| ◎ | 送血回路内圧を監視できる手段を有すること。 |
| ○ | 患者組織への十分な酸素供給を監視できる手段を有すること。 |
吸引回路
| ◎ | 接続部では、吸引回路であることが判断できる手段を有すること。 |
| ◎ | ポンプを用いてベントを行う場合には、逆流を防止する手段を有すること。 |
ガスライン
| ◎ | 清潔なチューブを使用すること。 |
| ◎ | 接続部ではガスラインであることが判断できる手段を有すること。 |
| ○ | ガスラインには異物を除去できる手段を有すること。 |
付属回路
(1)採血ライン
| ◎ | 送血回路への逆流を防止する手段を有すること。 |
その他
(1)注意事項
| ◎ | 陰圧吸引補助脱血を行う場合には、3学会合同陰圧吸引補助脱血体外循環検討委員会の勧告項目を備えること。 |
| ○ | 体外循環開始前に回路内の異物を除去できる手段を有すること。 |
接続例2:動脈血貯血槽を有する回路
◎必須 ○推奨
脱血回路
| ◎ | 接続部では、脱血回路であることが判断できる手段を有すること。 |
| ◎ | 患者組織への十分な酸素供給を監視できる手段を有すること。 |
| ◎ | 補助脱血手段を用いて脱血を行う場合には、回路内圧を監視できる手段を有すること。 |
| ○ | 循環血液量の不足を迅速に補うための手段を有すること。 |
送血回路
| ◎ | 接続部では、送血回路であることが判断できる手段を有すること。 |
| ◎ | 気泡や異物を除去できる手段を有すること。 |
| ◎ | 気泡や異物を除去できる部品と接続される気泡除去ラインには逆流を防止する手段を有すること。 |
| ◎ | 送血回路内圧を監視できる手段を有すること。 |
| ○ | 患者組織への十分な酸素供給を監視できる手段を有すること。 |
吸引回路
| ◎ | 接続部では、吸引回路であることが判断できる手段を有すること。 |
| ◎ | ポンプを用いてベントを行う場合には、逆流を防止する手段を有すること。 |
ガスライン
| ◎ | 清潔なチューブを使用すること。 |
| ◎ | 接続部ではガスラインであることが判断できる手段を有すること。 |
| ○ | ガスラインには異物を除去できる手段を有すること。 |
付属回路
(1)採血ライン
| ◎ | 送血回路への逆流を防止する手段を有すること。 |
その他
(1)注意事項
| ○ | 体外循環開始前に回路内の異物を除去できる手段を有すること。 |
接続例3:貯血槽を有さない回路
◎必須 ○推奨
脱血回路
| ◎ | 接続部では、脱血回路であることが判断できる手段を有すること。 |
| ◎ | 患者組織への十分な酸素供給を監視できる手段を有すること。 |
| ◎ | 補助脱血手段を用いて脱血を行う場合には、回路内圧を監視できる手段を有すること。 |
| ○ | 貯血槽を有さない回路の場合、気泡や異物を除去できる手段を有すること。 |
| ○ | 循環血液量の不足を迅速に補うための手段を有すること。 |
ポンプ回路
| ◎ | ポンプ出口の回路内圧を監視できる手段を有すること。 |
送血回路
| ◎ | 接続部では、送血回路であることが判断できる手段を有すること。 |
| ○ | 患者組織への十分な酸素供給を監視できる手段を有すること。 |
ガスライン
| ◎ | 清潔なチューブを使用すること。 |
| ◎ | 接続部ではガスラインであることが判断できる手段を有すること。 |
| ○ | ガスラインには異物を除去できる手段を有すること。 |
付属回路
(1)採血ライン
| ◎ | 送血回路への逆流を防止する手段を有すること。 |
その他
(1)注意事項
| ○ | 体外循環開始前に回路内の異物を除去できる手段を有すること。 |
|
お知らせ 医薬品・医療機器等安全性情報は、医薬品医療機器情報提供ホームページ(https://www.pmda.go.jp/)又は厚生労働省ホームページ(http://www.mhlw.go.jp/)からも入手可能です。 |
