RMP公表資料
- 「RMP提出品目一覧」から探す
- 「医療用医薬品 情報検索」から探す
情報検索ページでRMPを検索できます。
詳細な検索方法は情報検索機能の使い方[868.84KB]をご覧ください。
RMPとは
医薬品の安全性の確保を図るためには、開発の段階から市販後に至るまで常にリスクを適正に管理する方策を検討することが重要です。医薬品リスク管理計画(以下、RMP)は、医薬品の開発から市販後まで一貫したリスク管理をひとつの文書に分かり易くまとめ、調査・試験やリスクを低減するための取り組みの進捗に合わせて、または、定期的に確実に評価が行われるようにするものです。また、RMPを公表して、医療関係者の皆様と市販後のリスク管理の内容を広く共有することで、市販後の安全対策の一層の充実強化が図られることが期待されます。
RMP解説資料
RMPについて分かりやすく解説した資料を以下に掲載しております。
『3分でわかる!RMP講座』
RMPについて解説したA4 1枚の資料です。ダウンロードの上、ぜひご活用ください。
「3分でわかる!RMP講座」[943.11KB]
『今日からできる!How to RMP』
RMPおよび追加のリスク最小化活動のために作成・提供される資材について、病院薬剤師の先生が動画で解説しているe-ラーニングコンテンツです。「RMPってなに?編」と「RMPを使ってみよう!編」の2つがあり、どなたでも無料でご覧いただけます。
- RMPってなに?編
RMP及び追加のリスク最小化活動のために作成・提供される資材の基本的事項について
解説しています。資料はこちら[3.12MB]。
【チャプター】リンクをクリックすると各チャプターのところから閲覧可能です。
なお、動画は別ウィンドウにて再生されます。
- RMPを使ってみよう!編
RMPの実際の医療現場での活用方法について、具体例を交え紹介しています。
資料はこちら[2.25MB]。
【チャプター】リンクをクリックすると各チャプターのところから閲覧可能です。
なお、動画は別ウィンドウにて再生されます。
「今日からできる!How to RMP」の広報にご協力いただける方はこちら。
「3分でわかる!RMP講座」「今日からできる!How to RMP」に関するお問い合わせ先
電子メール: medinavi-ad[at]pmda.go.jp
(注)迷惑メール防止対策をしているため、 [at]を半角のアットマークに置き換えてください。
目的
これまでもICH E2Eガイドラインでは、医薬品の既知のリスクや未知のリスク等を要約して「安全性検討事項」として取り上げ、医薬品安全性監視計画を作成するように求めていましたが、医薬品のリスクを低減するための方法については記載されていませんでした。
2012年4月に、医薬品安全性監視計画に加えて、医薬品のリスクの低減を図るためのリスク最小化計画を含めた医薬品リスク管理計画(RMP: Risk Management Plan)を策定するための指針「医薬品リスク管理計画指針について」[314.26KB]がとりまとめられ、その後、具体的な計画書の様式、提出などの取扱いについて、「医薬品リスク管理計画の策定及び公表について」[255.67KB]で示されています。
この指針の活用により医薬品の開発段階、承認審査時から製造販売後の全ての期間において、ベネフィットとリスクの評価・見直しが行われ、これまで以上により明確な見通しを持った製造販売後の安全対策の実施が可能となることを目的としております。
概念図
RMPの中で、安全性検討事項(重要な特定されたリスク、重要な潜在的リスク、重要な不足情報)が設定され、各安全性検討事項に対して、医薬品安全性監視活動とリスク最小化活動の計画が策定されます。医薬品安全性監視活動とリスク最小化活動の実施状況や報告内容に基づいて、ベネフィット・リスクバランスが評価され、必要に応じてRMPの見直しが行われます。RMP全体のイメージを示した画像は以下のとおりです。
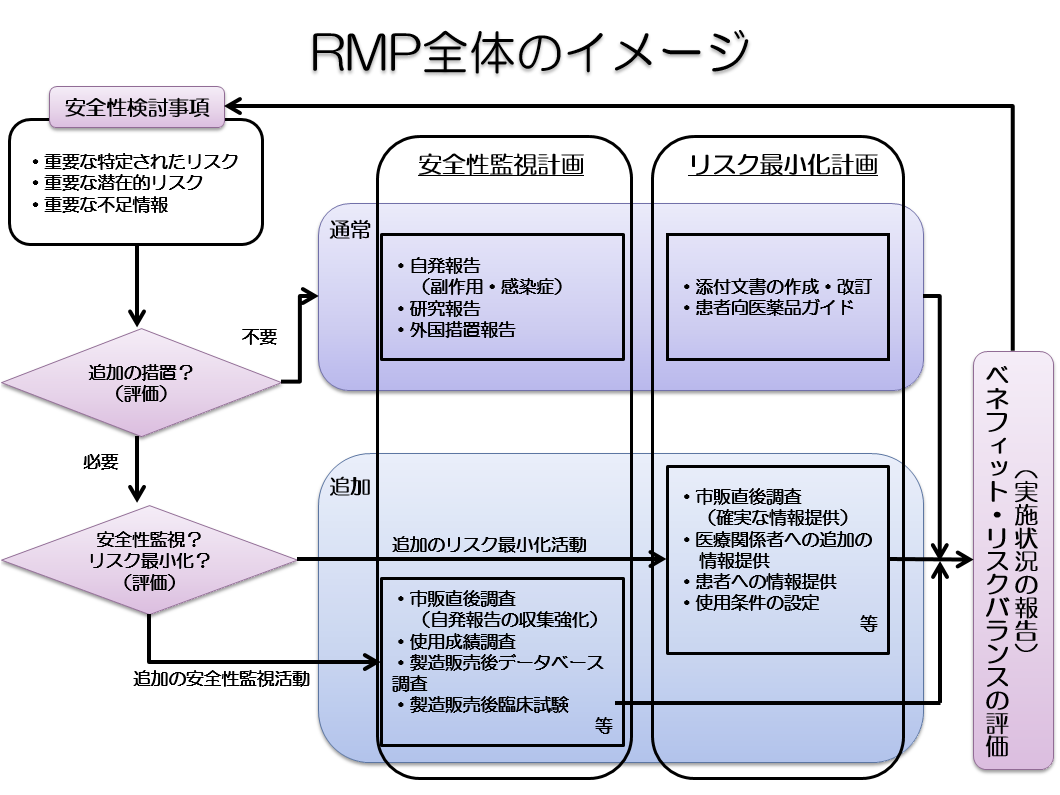
RMPの概要
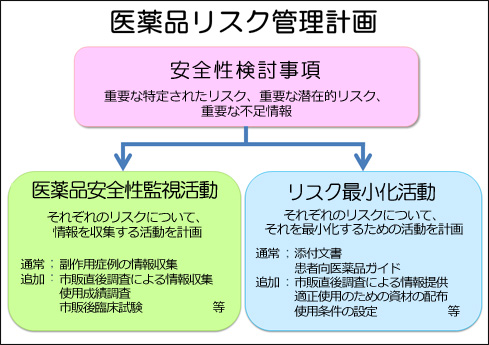
RMPとは、個別の医薬品ごとに、(1)重要な関連性が明らか、又は疑われる副作用や不足情報(安全性検討事項)、(2)市販後に実施される情報収集活動(医薬品安全性監視活動)、(3)医療関係者への情報提供や使用条件の設定等の医薬品のリスクを低減するための取り組み(リスク最小化活動)をまとめた文書です。
医薬品安全性監視活動とリスク最小化活動には、「通常」と「追加」の2種類の活動があり、「通常の活動」とは、全ての医薬品に共通して製造販売業者が実施する活動のことで、具体的には、副作用情報の収集、添付文書による情報提供などが該当します。一方、「追加の活動」とは、医薬品の特性を踏まえ個別に実施される活動のことで、市販直後調査、使用成績調査、製造販売後臨床試験、適正使用のための資材による情報提供などが該当します。
承認審査等の過程で「追加の活動」の実施が必要と判断された場合には、その内容を含むRMPが製造販売業者からPMDAに提出され、PMDAのウェブサイトで公開されます。
医薬品リスク管理計画の構成要素を示した画像は以下のとおりです。
関連資料
関連通知等
その他
- 医薬品・医療機器等安全性情報No.367[2.07MB]
- 医薬品・医療機器等安全性情報No.334[2.04MB]
- 医薬品・医療機器等安全性情報No.324[830.72KB]
- 医薬品・医療機器等安全性情報No.300[1.73MB]
- パブリックコメント 医薬品リスク管理計画ガイダンス(案)に対するご意見募集の結果について[256.57KB]
(2012年07月03日)
医薬品リスク管理計画書 記載事例
留意点
以下に示す記載事例は、「医薬品リスク管理計画の策定及び公表について」(2022年3月18日付け薬生薬審発0318第2号、薬生安発0318第1号厚生労働省医薬・生活衛生局医薬品審査管理課長、医薬安全対策課長連名通知)の別紙様式1(医薬品リスク管理計画書)、別紙様式2(医薬品リスク管理計画書の概要)及び別紙様式3(提出届)の表記方法の参考のために、例示として示すものです。安全性検討事項が本記載事例に挙げられているものと同じだとしても、必ずしも安全性監視活動及びリスク最小化活動について本記載事例と同じになるとは限りません。実際の策定の際には適応症、使用患者群など医薬品の特徴に応じて特定される安全性検討事項に基づき策定する必要があります。
