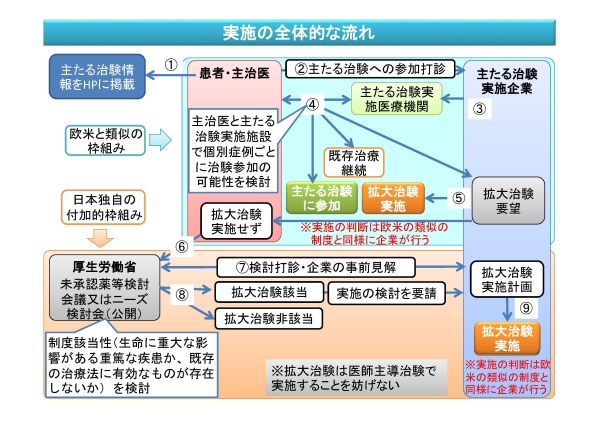
生命に重大な影響がある疾患であって、既存の治療法に有効なものが存在しない疾患の治療のため、未承認薬、未承認機器及び未承認再生医療等製品(以下、「未承認薬等」という。)を臨床使用するに当たっては、当該未承認薬等の使用によるリスクと期待される治療上のベネフィットのバランスを図りつつ、当該医薬品等の開発に支障を生じないことを前提として、これらの患者からのアクセスを確保するため、治験の参加基準に満たない患者に対して人道的見地から未承認薬等を提供する制度が導入されています(2016年(平成28年)1月22日付薬生審査発0122第7号、2016年(平成28年)7月21日付薬生機審発0721第1号)。
本制度は、上記の疾患を対象として、患者が享受できると期待されるベネフィットの蓋然性が比較的高いと考えられる国内開発の最終段階である治験(注)の実施後あるいは実施中(組入れ終了後)の治験薬、治験機器及び治験製品を、治験の枠組みのもとで提供するものです。
(注)通常、効能・効果及び用法・用量が一連の開発を通じて設定された後に実施される有効性及び安全性の検証を目的とした治験や、当該治験の結果をまとめた後、その結果をもって承認申請を予定している治験であり、これを「主たる治験」と呼びます。
制度の詳細についてはこちらをご確認ください。
(薬物)
| 通知番号等 | 通知名称 |
|---|---|
| 2024年(令和6年)9月13日 医薬薬審発0913第2号 |
人道的見地から実施される治験の実施について[336.40KB] |
| 2024年(令和6年)9月13日 事務連絡 |
人道的見地から実施される治験の実施に関する質疑応答(Q&A)について[262.81KB] |
| 2016年(平成28年)3月4日 薬生審査発0304第3号 |
人道的見地から実施される治験と患者申出療養の関係について[171.28KB] |
| 制度に関する参考資料(提供:厚生労働省医薬・生活衛生局審査管理課)[985.45KB] |
(機械器具等・加工細胞等)
| 通知番号等 | 通知名称 |
|---|---|
| 2022(令和4年)8月9日 薬生機審発0809第1号 |
「医療機器及び再生医療等製品における人道的見地から実施される治験の実施について」の改正について[228.31KB] |
| 2022年(令和4年)8月9日 事務連絡 |
「医療機器及び再生医療等製品における人道的見地から実施される治験の実施に関する質疑応答集(Q&A)」の改正について[153.79KB] |
| 2016年(平成28年)7月21日 薬生機審発0721第1号 |
医療機器及び再生医療等製品における人道的見地から実施される治験の実施について[222.54KB] |
| 2016年(平成28年)7月22日 事務連絡 |
医療機器及び再生医療等製品における人道的見地から実施される治験の実施に関する質疑応答集(Q&A)について[259.61KB] |
情報の公開
治験計画届書等としてPMDAに届け出られたもののうち、主たる治験及び人道的見地から実施される治験(拡大治験)の情報についてはPMDAのホームページで公開することとされております。
公開情報は以下の通りです。これらの情報は、毎月末を目処に更新予定です。
(注)現在公開しているのは、2025年9月30日に更新したものです。
主たる治験及び拡大治験の治験届出者へのお願い
公開用情報の登録をお願い致します。登録方法は以下の通りです。
(薬物)
- 主たる治験又は拡大治験として治験計画届書を届け出た場合
- 主たる治験又は拡大治験について、「被験薬、被験機器又は被験製品の追加」又は「本質的な対象疾患の変更」を行った治験計画変更届書を届け出た場合
- 治験計画を届け出た時点では主たる治験とは考えていなかったが、後に当該治験結果をもって承認申請を行うこととなり、「臨床試験の位置付け」を「主たる治験」に変更した変更届を届け出た場合
必要事項を入力の上、可能な限り速やかにメールでお送りください。別の治験で連絡先を既に登録している場合は(2)は不要です。
連絡先を変更する場合には、(2)をメールでお送りください。
(1)治験情報登録用フォーマット[17.9KB]
(2)治験届出者連絡先情報登録用フォーマット[11.8KB]
(機械器具等・加工細胞等)
- 主たる治験又は拡大治験として治験計画届書を届け出た場合
- 治験計画変更届にて拡大治験に変更する場合
- 主たる治験又は拡大治験について、「被験機器、被験製品または被験薬の追加」又は「本質的な対象疾患の変更」を行った治験計画変更届の場合
- 治験計画を届け出た時点では主たる治験とは考えていなかったが、後に当該治験結果をもって承認申請を行うこととなり、「主たる治験」に変更した変更届を届け出た場合
(1)及び(2)のフォーマットに記入し、その紙媒体及び電子媒体を届書の添付資料として提出してください。また、連絡先を変更する場合には、(2)をメールでお送りください(メールの送り先は、(2)の入力例の脚注参照)。なお、(1)及び(2)いずれもファイル形式はxlsx形式としてください。
(1)【治験届添付用】治験情報公開用フォーマット[18.3KB]
(2)【治験届添付用】治験届出者連絡先情報登録用フォーマット[12.9KB]
