概要
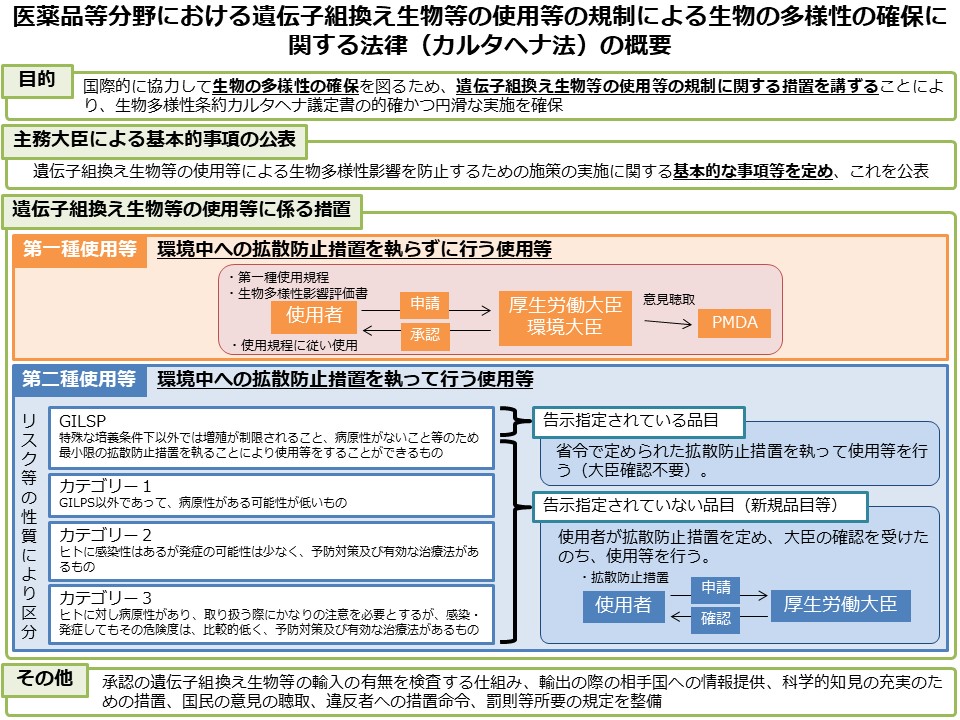
- 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)に基づき、第一種使用等(法第2条第6項の拡散防止措置を執らないで行う使用等)を行おうとする場合は、主務大臣(厚生労働大臣及び環境大臣)の承認が必要です。
- また、産業利用上の第二種使用等(法第2条第6項に示されている、施設、設備その他の構造物の外の大気、水又は土壌中への遺伝子組換え生物等の拡散を防止する意図をもって行う使用等)を行おうとする場合は、主務大臣(厚生労働大臣)の確認が必要です(ただし、運搬や保管のみの場合、GILSP告示に定められたGILSP遺伝子組換え微生物の使用等を除きます)。
- PMDAでは、第一種使用等の承認と第二種使用等の確認に関する審査等を行っています。
運用状況について
- 相談業務について
2019年度より、カルタヘナ法関連の相談業務を開始しています。
カルタへナ相談の概要資料 [693KB]
カルタへナ相談のページ(PMDAウェブサイトリンク)
Japanese Pharmaceutical Regulations of Engineered Viral Vectors for Medical Use Compared with those in the United States and the European Union.(外部リンク)
Clin Pharmacol Ther. 2022. doi:10.1002/cpt.2788. PMID: 36404404
オンライン提出について
2022年12月1日より、以下の手続について、申請電子データシステム(ゲートウェイシステム)によるオンライン提出が可能になりました。
【PMDA再生医療製品等審査部宛】
- 第一種使用規程承認申請
- 第一種使用規程変更申請
- 第二種使用等拡散防止措置確認申請
- 第一種住所等変更届出
- 第二種住所等変更届出
- 第二種軽微変更届出
<医薬品、医薬部外品又は化粧品の場合>
【厚生労働省医薬局医薬品審査管理課長宛】
- 遺伝子治療用製品等又は遺伝子組換え生物等の評価に影響を及ぼす知見を発見した場合の報告
- 遺伝子組換え生物等の状況報告
- 遺伝子治療用製品等の状況報告
- 第一種使用規程変更届出
<医療機器、体外診断用医薬品又は再生医療等製品の場合>
【厚生労働省医薬局医療機器審査管理課長宛】
- 遺伝子治療用製品等又は遺伝子組換え生物等の評価に影響を及ぼす知見を発見した場合の報告
- 遺伝子組換え生物等の状況報告
- 遺伝子治療用製品等の状況報告
- 第一種使用規程変更届出
オンライン提出を行うためには、事前にゲートウェイシステムへのユーザー登録や電子証明書の取得が必要です。詳しくはゲートウェイシステムのウェブサイトでご確認ください。
【関連通知】
- カルタヘナ法に基づく手続のオンライン化について [350KB](2022年(令和4年)12月1日)
- 「カルタヘナ法に基づく手続のオンライン化について」の一部改正について [132KB](2023年(令和5年)8月29日)
(様式番号・名称の更新に伴う一部改正通知。最新の様式は一部改正通知を御確認ください。)
【申請電子データシステム(ゲートウェイシステム)ウェブサイト】
https://esg.pmda.go.jp/Ssk/comn001p01.init
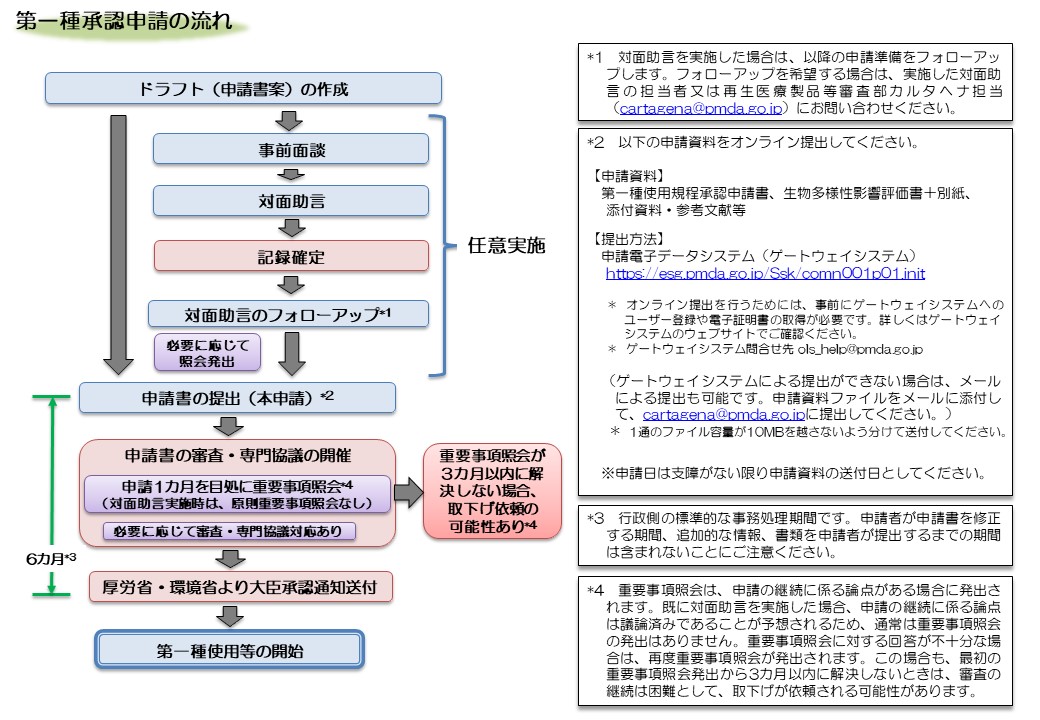
第一種使用等に係る承認申請等の手続について
-
第一種使用規程承認申請
-
第一種使用規程変更申請
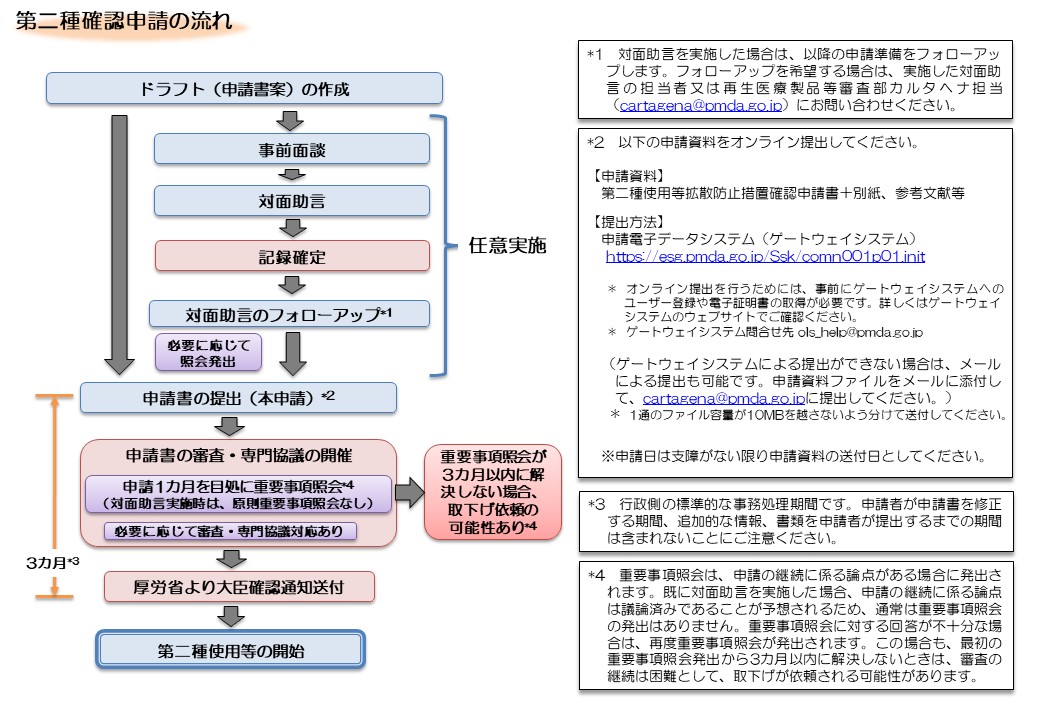
第二種使用等に係る確認申請等の手続について
-
第二種使用等拡散防止措置確認申請
お問合せ
申請書等の提出又は申請等の手続方法に係るご質問は下記メールアドレスにお送りください。(なお、申請等の内容に関係する場合はカルタへナ法関連相談事前面談をお申し込みください。)
再生医療製品等審査部
E-mail:cartagena[at]pmda.go.jp
(迷惑メール防止対策をしているため、[at]を半角のアットマークに置き換えてください)
電話番号:03-3506-9471