医療機器又は体外診断用医薬品の製造販売業者や登録製造所に対して、医療機器及び体外診断用医薬品の製造管理及び品質管理に関する基準であるQMS(Quality Management System)に適合し、適正な品質の製品が製造される仕組みになっているかどうかを、PMDAが調査しています。
<お知らせ>
- QMS適合性調査申請は、2022年7月1日よりゲートウェイを利用したオンライン提出が可能です。
- リンク先の文書について、「品質管理部」とあるのは「医療機器品質管理・安全対策部」と、「品質管理部 医療機器品質管理課」とあるのは「医療機器品質管理・安全対策部 医療機器品質管理課」と読み替えをお願い致します。
医療機器等適合性調査の申請資料については、以下の点にご留意ください。
- 「基準適合証及びQMS適合性調査申請等の取扱いについて」(令和2年8月31日付、薬生監麻発0831第1号、薬生機審発0831第16号)
- 「カテーテル(クラスIV)の製品群の考え方について」(平成31年1月4日付改正、医療機器品質管理・安全対策部事務連絡)
- 「開示請求により交付された基準適合証等の写しについて」(平成31年1月4日付改正、品質管理部事務連絡)
- 「後発医療機器及び改良医療機器(臨床試験データが不要な場合に限る。)に係る製造販売承認申請時のQMS適合性調査申請について(再周知)」(平成27年7月10日付、薬食機参発第0710第1号、薬食監麻発第0710第18号)
- MDSAPの概要、申請書及び提出資料については「MDSAPに関する業務」に掲載された関連通知をご覧ください。
<基準適合証の書換え交付について>
基準適合証記載事項のうち、書き換えることができる事項については、令和2年8月31日付け薬生監麻発0831第1号、薬生機審発0831第16号「基準適合証及びQMS適合性調査申請等の取扱いについて」に示されているところです。今般、特に相談の多い書換え交付申請することができる事項に関連しまして、当該事項に該当しない事例を以下のとおり列挙しましたのでご確認ください。
QMS調査の流れ(概要)
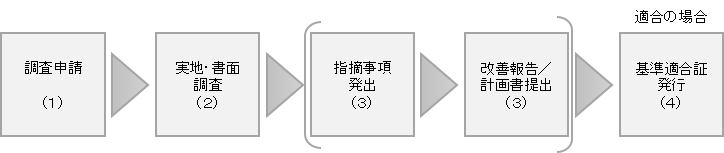
(1)調査申請
◆申請時期について
後発医療機器及び改良医療機器については、「後発医療機器及び改良医療機器(臨床試験データが不要な場合に限る。)に係る製造販売承認申請時のQMS適合性調査申請について(再周知)」(平成27年7月10日付、薬食機参発第0710第1号、薬食監麻発第0710第18号)において、調査申請は、承認申請後速やか(遅くとも10日以内)に行うこととされています。申請の目安は下記の通りです。

注意事項
承認及び調査の申請窓口は審査業務部です。
申請に係る手続きについては「受付業務について」を参照ください。
<ゲートウェイを利用したオンライン提出の場合>
調査申請書及び資料の電子データをゲートウェイを利用して提出する際に利用する「申請電子データシステム」の利用手順等に関しては 申請電子データシステムに関する情報 をご確認ください。
なお、ゲートウェイを利用した調査資料のオンライン提出に係る留意事項等については、本ホームページ <申請に当たって提出すべき資料について> をご確認ください。
<窓口(FD申請・DWAP申請)受付の場合>
承認申請受付番号が窓口にて通知されます。通知された承認申請受付番号を調査申請データに追記し、調査申請書を審査業務部にご提出ください。
<郵送受付の場合>
承認申請書の受付完了後、承認申請受付番号を記載した「受付票(正)」を郵送いたします((1)から5日後頃までに到着予定。)。通知された承認申請受付番号を調査申請データに追記し、審査業務部に調査申請書をご提出ください。
<承認申請とQMS適合性調査申請の同時申請について>
DWAP申請及びFD申請については、同時申請が可能です。詳細については、以下の事務連絡をご参照ください。
DWAP申請についてはこちら(2017年4月3日運用開始)
FD申請についてはこちら(2018年8月1日運用開始)
QMS適合性調査の申請に当たって提出すべき資料のうち、実地/書面調査の判定のために提出する資料については、その一部でも添付されていない場合は実地/書面の判定ができず、調査の開始が大きく遅れることになりますので、事前に準備の上、申請いただきますようお願いいたします。
また、医療機器等適合性調査申請書は、FD申請又は医療機器WEB申請にてご提出くださいますよう、ご協力をお願いします。
◆申請書作成の際の留意点について
適合性調査申請書の以下の項目の誤記が増加しております。
申請書の差替え等により、調査期間の延長につながる可能性がございますので、申請書の記載内容については十分にご確認ください。
【経過措置対象品目の細区分】
誤った選択をされるケースが増えております。製品群の選択について(13ページ)をご確認の上、適切な区分を選択して下さい。
◆申請に当たって提出すべき資料について
医療機器等適合性調査の申請に当たって提出すべき資料については、以下の資料をご確認ください。
「QMS適合性調査の申請に当たって提出すべき資料について」の別紙3(提出資料一覧)をチェックの上(添付の有無は問いません)、1.実地/書面調査の判定のために提出する資料を全て取り揃えた上で提出してください。2.書面調査のために提出する資料については、書面調査と判定された後の提出で構いません。
2021年の省令改正の前後で様式に記載される条文に若干の変更があります。適用の省令に合わせてご利用ください。
- QMS適合性調査の申請に当たって提出すべき資料について
- 様式1(宣誓書)
- 様式2(調査対象施設の概要)
- 様式3(子品目(調査対象品目)リスト):
- 様式4(宣誓書)
- 別紙4(カバーレター)
- QMS適合性調査の申請に当たって提出すべき資料について(平成31年4月1日改正)
- 様式1(宣誓書)
- 様式2(調査対象施設の概要)
- 様式3(子品目(調査対象品目)リスト):
- 様式4(宣誓書)
- 別紙4(カバーレター)
【様式3(子品目リスト)に関する注意事項】
- 子品目がない場合は、カバーレターの備考欄に「子品目なし」と記載してください。その場合、子品目リストの提出は不要です。
- 子品目リストはA3で印刷したものを提出してください。
- 複数同時申請の場合、子品目リストは申請毎に作成してください。
- その他留意事項は子品目リストの記載例に記載しています。記載例を確認の上、提出してください。
「実地/書面調査の判定のために提出する資料」・「書面調査のために提出する資料」の一覧表及び海外登録製造所に関係すると考えられる提出資料の記載例等を英訳化しました。
あくまで参考訳です。正式文書ではありません。
その他、以下リンク先の厚生労働省ホームページよりQMS適合性調査手数料計算ツールをダウンロードし、計算結果シートを添付してください。
MDSAP利用申請においてもこちらの手数料計算ツールをご利用ください(申請時はMDSAP報告書の利用手数料分は考慮に含めず、従前のとおりに手数料を計算してください)。また、MDSAP報告書の利用手数料の追納に係る手順は調査終了前に調査担当者よりご案内いたします。
- QMS適合性調査手数料計算ツール(https://web.fd-shinsei.mhlw.go.jp/download/qmscalc/index.html)
【提出資料を製造所から機構に直送する場合】
- 申請をオンライン提出している場合においては、製造所から直送を希望する旨を調査申請資料あるいはカバーレターに記載し、機構からの指示に従いオンライン提出をすること。
- 郵送による申請においては、調査申請のシステム受付番号、販売名及び製造販売業者(申請者名)を明らかにし、以下の宛先まで郵送すること。
独立行政法人 医薬品医療機器総合機構
医療機器品質管理・安全対策部 医療機器品質管理課
〒100-0013
東京都千代田区霞が関3-3-2 新霞が関ビル
Office of Manufacturing / Quality and Vigilance for Medical Devices
Division of Inspection for Medical Devices
Pharmaceuticals and Medical Devices Agency (PMDA)
Shin-kasumigaseki Building, 3-3-2, Kasumigaseki,
Chiyoda-ku, Tokyo 100-0013 JAPAN
(2)実地・書面調査
医療機器等適合性調査申請後、各施設に対する調査方法(実地調査又は書面調査)を申請者に通知します。
書面調査の場合、ご提出いただく資料については、(1)調査申請の「医療機器等適合性調査の申請に当たって提出すべき資料について」をご確認ください。
実地調査の場合、調査担当から申請者へ実地調査の詳細をご連絡します。
(3)指摘事項発出、指摘事項改善報告/計画書の提出
QMS調査において不備事項が確認された場合、「QMS調査指摘事項書」を調査対象者宛に発行します。
当該文書に記載された期限内に、調査対象者は、「QMS指摘事項改善報告書」又は「QMS指摘事項改善計画書」をPMDAへ提出してください。
指摘事項には、重篤度に応じてランク付けがされており、ランクによって対応期限及び方法が異なります。
詳細は「QMS調査要領について」(薬生監麻発0326第12号)をご確認ください。
「QMS指摘事項改善報告書」、「QMS指摘事項改善計画書」の様式は、以下を使用してください。
(4)基準適合証発行
適合性調査申請に関連した全ての施設の調査が終了し、調査結果が適合であった場合、以下の文書を申請者へ郵送します。
- 基準適合証又は追加的結果証明書
- 医療機器/体外診断用医薬品適合性調査結果通知書の写し
- 医薬品医療機器法施行規則第114条の34第2項の規定による書類(該当する場合のみ)
- QMS調査結果総括報告書の写し
- QMS調査結果報告書の写し(実地調査を行なった施設がある場合のみ)
QMS調査に関する問い合わせについて
- 申請前の問合せ
個別の品目に関わらない通知、制度等についての問合せ。また、機構が調査権者となるQMS調査の申請前の相談等については 全般相談に問合せください。
機構が調査権者となるQMS調査に係る手続きに関する事項、手数料の合理化等についての問い合わせについては簡易相談に問合せください。
QMS調査に関する簡易相談に添付する資料について(改定箇所: 様式1、様式2(2015年1月30日))
様式:医療機器版(2021年6月18日改訂)、体外診断用医薬品版(2021年6月18日改訂)
申請方法
- 申請手続き等に係る問合せ
FD、DWAPなど各種申請・届出等の申請手続き自体に関する問合せは審査業務部へご連絡ください。
- 申請済み調査についての問合せ
既に申請済みの調査の進捗、手続き等の問合せ。
医療機器品質管理・安全対策部 医療機器品質管理課 宛
表題に「調査システム受付番号」及び「申請者名(法人)」を明記の上、ご連絡ください。
電子メール: kikiqms-shinchoku_●_pmda.go.jp 又は ファクシミリ:03-3506-9405
(注)迷惑メール防止対策をしているため、送信の際は_●_を半角のアットマークに置き換えてください。また、本メールアドレスはセキュアメール(電子証明書による署名を付し、暗号化したもの)に対応しておらず通常の電子メールとなりますので、ご利用の際はその旨をご了解の上、お申込み願います。
参考情報
◆QMS省令
- 医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令(平成16年厚生労働省令第169号)(e-gov法令検索結果へリンク)
- 医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令の一部を改正する省令(厚生労働省 法令検索の結果へリンク)
◆改正法理解のための参考資料について
QMSに関連した制度改正の参考資料です。調査申請の際にご活用ください。
◆関連する通知等
◆講習会資料について
過去に実施した講習会のスライドです。調査申請等にご活用ください。
- 令和4年_福岡県医療機器関連セミナー講演資料
- 令和5年_神奈川県医療機器工業会講演資料
- Part1 QMS適合性調査の目的について
- Part2 QMS適合性調査の調査手続き及び申請資料について
- Part3 QMS適合性調査のオンライン提出について
- Part4 MDSAP報告書の利用申請について
◆厚生労働科学研究 GMP、QMS、GCTP及び医薬品添加剤のガイドラインの国際整合化に関する研究について
2014年から2020年度に実施した厚生労働科学研究(QMS分野)において、以下の文書を作成しました。
「厚生労働科学研究(QMS分野)について」に当該文書を掲載していますので、業務の参考にご活用ください。
<作成した文書>
- QMS適合性調査における指摘事例及び適合にむけての考え方について(2017年版)
- 輸入販売業者向け品質管理監督システム基準書(品質マニュアル)作成事例について(2017年改定)
- 国内で最終製品の保管のみを行う製造所(倉庫業)の品質マニュアル作成事例について
- QMS調査結果報告書記載事例
