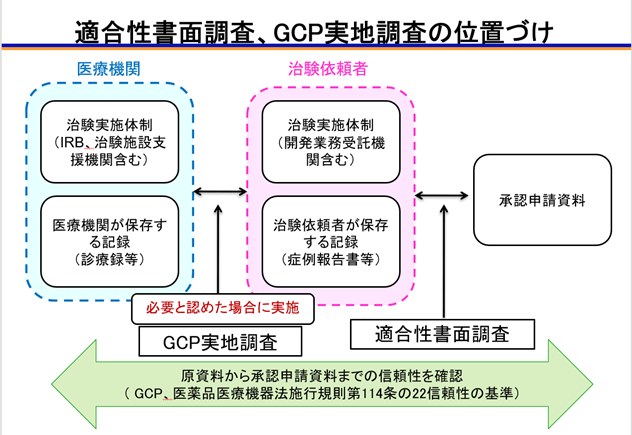
医療機器の製造販売承認申請書に添付すべき臨床試験の成績等の資料(承認申請資料)の根拠となる試験が、GCP、適切な試験計画書に従い、倫理的、科学的に適切に実施されているか、また、「申請資料の信頼性の基準」(医薬品医療機器法施行規則第114条の22)に従って、適切かつ正確に承認申請資料が作成されているかどうかを、当該承認申請資料の根拠となった資料(根拠資料。生データを含む)に基づいて、書面又は実地により調査します。
新医療機器、改良医療機器(臨床あり)、改良医療機器(臨床なし)及び後発医療機器の全ての申請品目が書面による調査の対象となります。書面による調査を行なった結果、必要であると認めた場合、又はその他必要であると認めた場合に実地による調査を実施します。
申請者におかれましては、申請にあたって、根拠資料(生データを含む)をあらかじめ入手し、承認申請資料の正確性等を確認しておくなど、適合性書面調査実施のための準備をお願いいたします。
適合性書面調査
(1)実施手続きについて
- 医療機器の臨床試験に係る承認申請資料の適合性書面調査及びGCP実地調査の実施手続きについて(薬機発第0824032号 [300.74KB])
- リモート調査にて実施する場合は、こちらもご参照ください。
- 陳述書
根拠資料の原本を提出できない場合には、医療機器調査・基準部長宛に原本を提出できない理由及び提出する文書が原本の正確な写しである旨を証する文書を根拠資料提出時にあわせて提出してください。
記載例はこちら [20.2KB]
- 押印廃止に伴い、適合性書面調査の実施通知書及び結果通知書は、2024年4月より電子メール経由で交付します。
GCP実地調査
(1) 実施手続きについて
- 医療機器の臨床試験に係る承認申請資料の適合性書面調査及びGCP実地調査の実施手続きについて(薬機発第0824032号 [300.74KB])
- 押印廃止に伴い、GCP実地調査の実施通知書、結果通知書その他の文書は、2024年4月より電子メール経由で交付します。
チェックリスト
【書面調査】
- 医療機器の臨床試験の信頼性に関するチェックリスト [152.64KB]
- 資料詳細目録記載例 [2.67MB] 2022年8月24日 更新
【書面調査/GCP実地調査】- 医療機器GCP適合性調査チェックリスト
- 治験依頼者用 [231KB](共通) 2021年12月23日 更新
- 医療機関用 [212KB](GCP実地調査)
【参考】
- EDC管理シート(治験依頼者用/製造販売業者用)version.2.00 [49.4KB]
(注)version1.00からの変更箇所はこちら [56.5KB]をご覧ください。 - EDC調査チェックリスト(医療機関用) [32.0KB]
各種関連通知
臨床試験に係る承認申請資料の適合性書面調査及びGCP実地調査の実施手続き等の通知は、こちらをご確認ください。
なお、各種様式は「各種様式ダウンロード >審査業務関連 >調査申請関係(GLP/GCP/GPSP)」よりご利用いただけます。
