独立行政法人医薬品医療機器総合機構(PMDA;Pharmaceuticals and Medical Devices Agency)は、2001年に閣議決定された特殊法人等整理合理化計画を受けて、国立医薬品食品衛生研究所医薬品医療機器審査センター、医薬品副作用被害救済・研究振興調査機構及び財団法人医療機器センターの一部の業務を統合し、独立行政法人医薬品医療機器総合機構法に基づいて2004年4月1日に設立され、業務を開始しました。
PMDAは、医薬品の副作用や生物由来製品を介した感染等による健康被害に対して、迅速な救済を図り(健康被害救済)、医薬品や医療機器などの品質、有効性および安全性について、治験前から承認までを一貫した体制で指導・審査し(承認審査)、市販後における安全性に関する情報の収集、分析、提供を行う(安全対策)ことを通じて、国民保健の向上に貢献することを目的としています。
名称
独立行政法人 医薬品医療機器総合機構
Pharmaceuticals and Medical Devices Agency(PMDA)
設立
2004年4月1日
法人の種別
中期目標管理法人
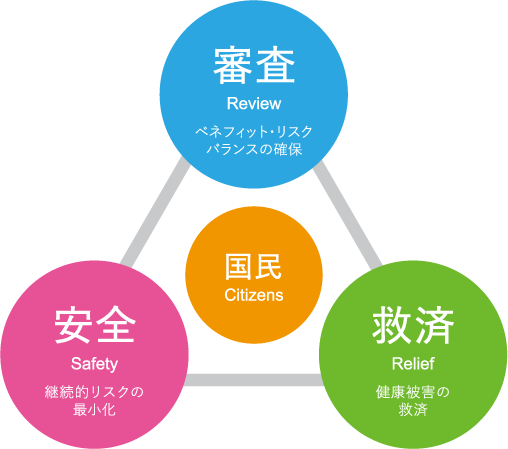
PMDAの果たす3つの役割
セイフティ・トライアングル
3つの業務による総合的なリスクマネジメント
PMDAは、医薬品などの健康被害救済、承認審査、安全対策の3つの役割を一体として行う世界で唯一の公的機関として、レギュラトリーサイエンスに基づき、より安全でより品質のよい製品をより早く医療現場に届け、医療水準の向上に貢献しています。
PMDAの業務のご案内
PMDA業務案内[5.08MB](別ウィンドウで開く)

- 健康被害救済業務
- 医薬品副作用被害救済に関する業務
- 生物由来製品感染等被害救済に関する業務
- スモン患者への健康管理手当などの受託・貸付業務
- HIV感染者、エイズ発症者に対する健康管理費用などの受託給付業務
- 「特定フィブリノゲン製剤及び特定血液凝固第Ⅸ因子製剤によるC型肝炎感染被害者を救済するための給付金の支給に関する特別措置法」に基づく給付金の支給等業務
- 承認審査業務
- 治験などに関する相談業務
- 医薬品、医療機器、再生医療等製品等の承認審査業務
- 再審査・再評価業務
- 承認申請資料などの内容に関する信頼性調査業務
- GCTP等の調査業務
- 登録認証機関に対する調査等業務
- 日本薬局方などの基準作成調査業務
- 安全対策業務
- 注意事項等情報の届出の受付業務
- 製造販売業者又は医療機関からの副作用などに関する情報の収集・整理業務
- 科学的分析などを通じた安全対策に資する調査・分析業務
- 製造販売業者からの安全対策に関する相談業務
- 一般の方などからの相談への対応
- 医薬品、医療機器、再生医療等製品等の安全性に関する情報提供業務
