医療機器審査の相談区分について
大臣承認の申請区分について
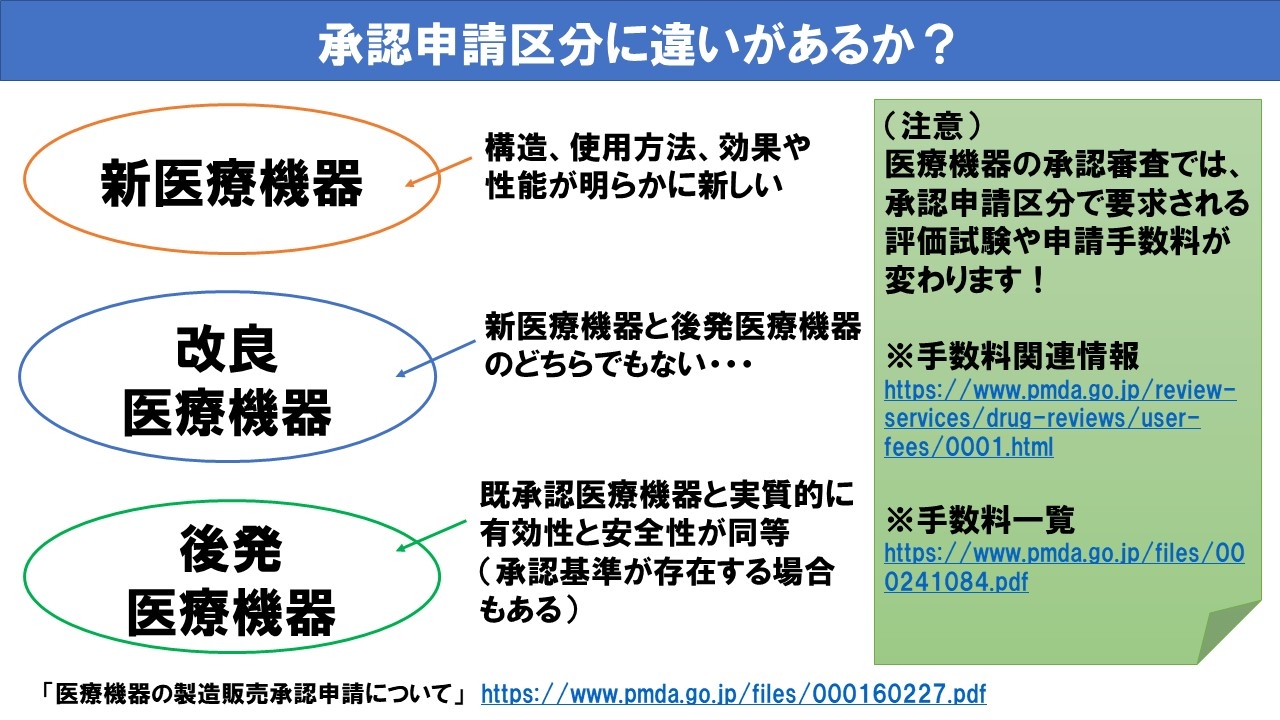
- 「新医療機器」とは構造、使用方法、効果や性能が明らかに新しい製品が該当します。
- 「改良医療機器」とは新医療機器と後発医療機器のどちらにも当てはまらない製品が該当します。
- 「後発医療機器」とは既承認医療機器と実質的に同等の製品が該当します(承認基準が存在する製品もあります。)。
申請区分ごとの審査期間の目安について
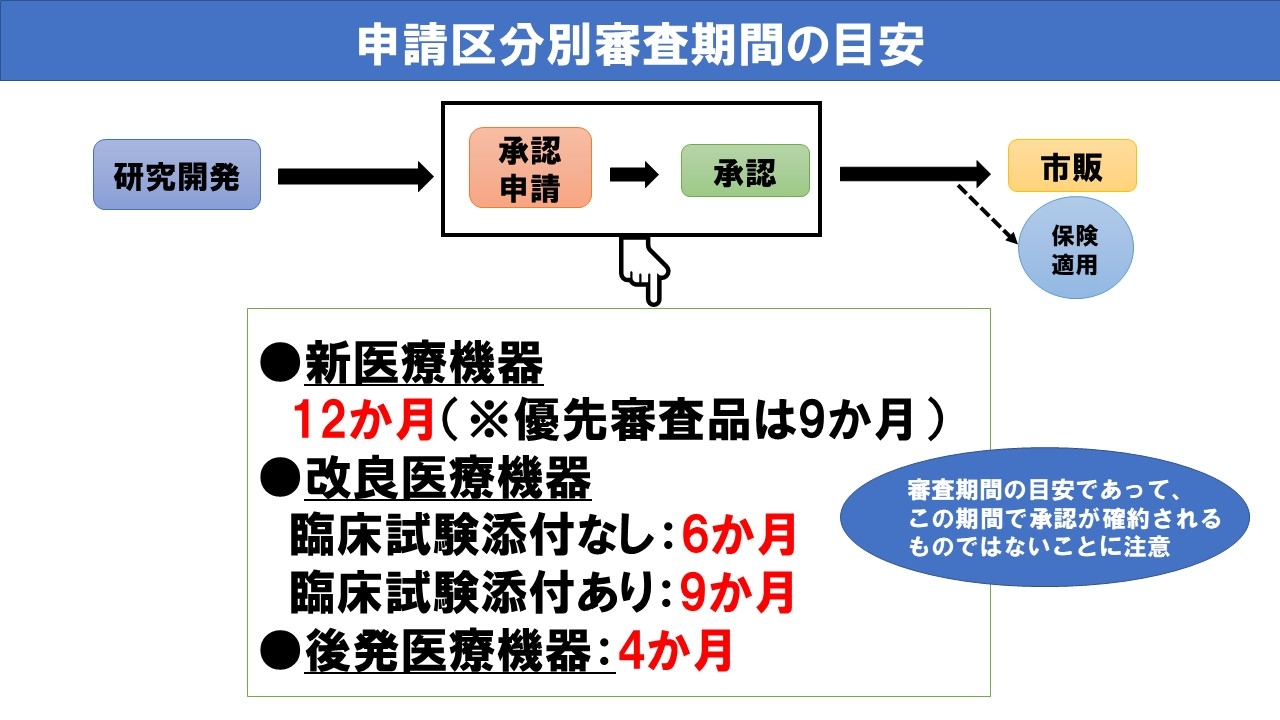
承認審査の申請区分別の総審査機関の目安については、2008年に厚生労働省が設定した「医療機器の審査迅速化アクションプログラム」において示されており、おおよその承認期間の目安は以下に示すとおりです。
- 新医療機器区分は12か月(ただし、優先審査品目は9か月)
- 改良医療機器臨床あり区分は9か月
- 改良医療機器臨床なし区分は6か月
- 後発医療機器区分は4か月
プログラム医療機器について
「プログラム医療機器」とは医療機器としての目的性を有しており、かつ、意図したとおりに機能しない場合に患者(又は使用者)の生命及び健康に影響を与えるおそれがあるプログラム(ソフトウェア機能)(人の生命及び健康に影響を与えるおそれがほとんどないもの(一般医療機器に相当するもの)を除く。)が該当します。
大臣承認審査に関係する調査について
- 基準適合性調査(いわゆる信頼性調査)とは申請書に添付された試験が適切に実施・収集・作成され、その試験結果が適切かつ正確であることを調査します。
信頼性調査についての情報はこちら - QMS調査とは、医療機器等の製造管理や品質管理が適正な仕組みとなっているかを調査します。
QMS調査についての情報はこちら
医療機器承認品目リストについて
- 承認品目の一覧情報はこちら
(注)新医療機器の審査報告書はこちらの検索画面からご確認ください。
医療機器変更計画確認品目リストについて
医療機器の一般的名称について
医療機器に特化した承認制度について
承認審査についてのトピック
- 軽微変更・一部変更手続きに関する情報
- 生物学的安全性評価と原材料変更に関する情報
- 臨床評価に関する情報
- 医療機器の「臨床試験の試験成績に関する資料」の提出が必要な範囲等に係る取扱いについて
- 臨床評価報告書及び臨床評価相談用資料作成の手引き part1:作成手順[460KB]
- 臨床評価報告書及び臨床評価相談用資料作成の手引き part2:臨床評価報告書受け入れの基本的な考え方[839KB]
その他、臨床評価報告書の作成手引きに関する情報は、医機連のホームページをご参照ください。 - 臨床評価報告書の記載事(1)[803KB]
- 臨床評価報告書の記載事例(2)[891KB]
その他、臨床評価報告書の記載事例に関する情報は、医機連のホームページをご参照ください。
- 再製造医療機器に関する情報
- 植込み医療機器のMR安全性に関する情報
- 医療機器のユーザビリティ、サイバーセキュリティーに関する情報
- 「革新的医療機器等相談承認申請支援事業」の実施についてはこちら
PMDAでは、国からの補助金事業として、一定条件の中小・ベンチャー企業に対し、要件を満たす医療機器・再生医療等製品・体外診断用医薬品に係る相談・承認申請の手数料について、全額納付後に5割を助成する「革新的医療機器等相談承認申請支援事業」を実施しています。
- 「小児用医療機器の承認申請支援事業」の実施についてはこちら
PMDAでは、国からの補助事業として、小児用医療機器に係る承認・調査申請の手数料について、全額納付後に9割(但し、一定の条件があり、また補助金額に上限があります)を助成する「小児用医療機器の承認申請支援事業」を実施しています。
- 米国等に先駆けてわが国で開発又は承認された医療機器の例
審査の考え方・ポイント
海外当局との協働
【参考】過去実施した業界との合同作業部会成果物など
注意:ここに掲載されている資料は参考資料です。薬事承認申請を行う際は、最新の通知、ガイダンス、規格などを参照してください。その他、ご不明な点がございましたら、医療機器全般相談などをご活用ください。
原材料変更関連
- 人工腎臓装置の製造販売承認申請書における原材料記載について[396KB]
- 医療機器の製造販売承認申請書における原材料の記載と変更について(案)[173KB]
- 「医療機器の製造販売承認申請書における原材料の記載と変更について」に関する質疑応答集(Q&A)(案)[138KB]
- 「医療機器の製造販売承認申請書における原材料の記載と変更について」に関する具体的事例[520KB]
申請書記載関連
- 合同作業部会WG9 サブワーキンググループの検討内容について
- 同時申請における資料・審査手順の合理化について[247KB]
- 承認内容変更に際して必要な手続きの判断に利用する、ディシジョンツリーについて[327KB]
過去の申請書類チェックリスト
- 後発医療機器の承認申請書類の確認について(2015年3月31日まで)[314KB]
- 後発医療機器の承認申請資料の確認について(改訂版2015年4月1日より)[237KB]
- 後発医療機器の承認申請書類にかかるチェックリストの改訂について(2015年12月25日改訂)[218KB]
デバイス・ラグの試算についてはこちら
