医薬品の承認審査に関しては、「日本再興戦略」(2013年6月14日閣議決定)において PMDA の強化の必要性が指摘され、さらに、「健康・医療戦略」(2013年6月14日関係大臣申合せ)では、「PMDA 自らが臨床データ等を活用した解析や研究を進め、審査・相談において、より合理的で効率的な評価・判断プロセスの構築を進める」こととされています。
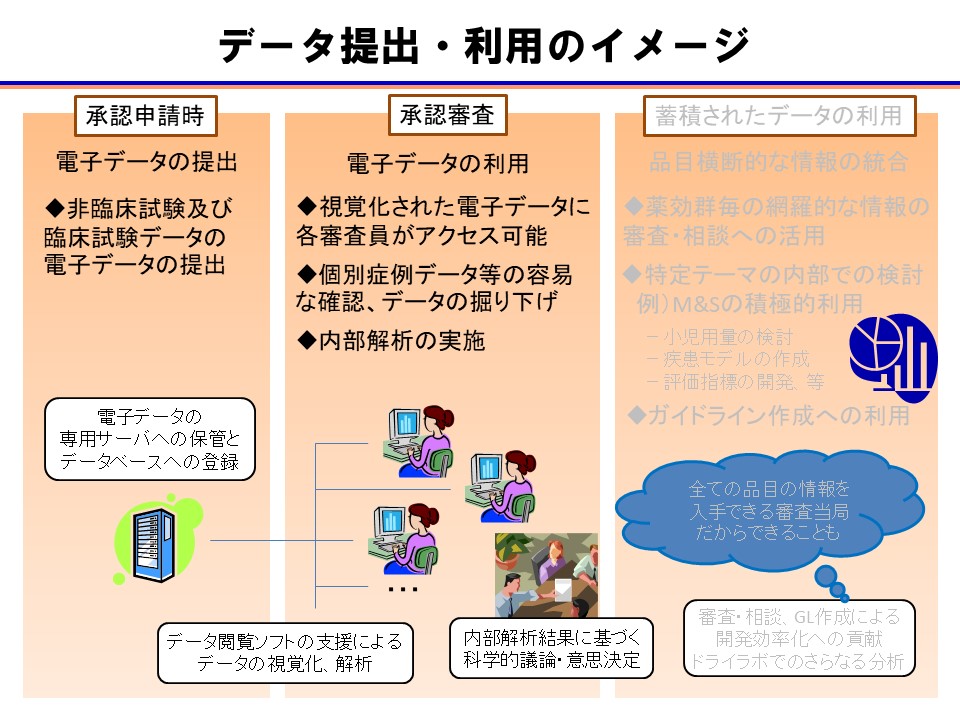
PMDA自らがデータを活用した解析や研究を実施するためには、まず、 PMDAに提出される臨床試験成績が電子データとして提出されることが重要となります。臨床試験成績を電子データとして収集することで、個々の品目の承認審査において様々な解析が可能となり、より客観的で科学的な意思決定につながり、承認審査の質の更なる向上に資するものと考えられます。また、様々な品目に関する試験データを同様に集積することで、品目横断的な検討が可能となるとともに、近年注目されている Modeling & Simulation 等の活用にもつながるものと考えられます。例えば、薬物動態と臨床効果との関連、臨床効果の用量反応性、疾患の経過や予後等について、より精度の高い予測が可能になると期待されています。特に、希少疾病用医薬品や小児用の医薬品の開発については、患者数が少なくデータ集積が困難であることや、適切な評価方法が未確立であることにより困難を伴う場合が多いが、集積した電子データを用いた研究を進めることで、その効率化に寄与すると考えられます。
一方、承認申請時等に電子データを提出することは、申請者側にも多くの利点があると考えられます。第一に、 PMDA で実施した様々な解析の結果を承認審査、対面助言等に役立てることで、申請者における医薬品開発の効率化、開発成功率の向上等に寄与すると考えられます。第二に、承認申請時の申請者側の負担が軽減されると考えられます。例えば、従来の承認審査における PMDA からの照会事項では、申請者に臨床試験データに関する再解析を求める場合も多かったが、 PMDA が自ら解析を実施することにより、照会事項の減少又はその内容の明確化につながることが期待されます。さらに、国際的に広く使用されている
電子フォーマットに基づく臨床試験データの収集が我が国で定着すれば、 PMDA及び申請者の両者において、国際連携を視野に入れたより適切かつ最先端の解析・評価等を実施できるようになり、国際共同研究及び開発の推進にもつながるものと考えられます。
このページでは、申請電子データ提出に関する各種情報を掲載しています。
関連通知・様式等
申請電子データ提出に関する技術情報(FAQ、データカタログ等)
説明会・講演会に関する情報(過去の説明会・講演会の発表資料も掲載しています)
申請電子データシステムに関する情報
電子データの提出内容(仕様等、定義ファイルやデータセット作成用プログラムを含む)等に関しては「医薬品申請電子データの提出に係る相談」をご利用いただけます。
このページの内容についてのお問い合わせ先
電子メール:e-secretariat[at]pmda.go.jp
(迷惑メール防止対策をしているため、送信の際は[at]を半角のアットマークに置き換えてください。)
なお、物品・サービスの販売や販売促進を目的としたお問い合わせ等はご遠慮ください。
(必ずしも個別のお問い合わせ全てに回答できるものではございません。予めご了承ください)
