PMDAでは承認審査業務として、医療現場で使用する医薬品、医療機器、再生医療等製品や、日常生活で使用する一般用医薬品・要指導医薬品、医薬部外品について、品目ごとに品質、有効性、安全性の審査を行っています。
承認審査業務では、提出された申請資料の内容が倫理的かつ科学的に信頼できるかどうかを調査する「信頼性調査」、信頼性調査の結果を踏まえて申請された製品の効果や副作用、品質について現在の科学技術水準に基づき、審査を行う「承認審査」、申請された製品を製造できる能力を有するかどうかを調査する「GMP/QMS/GCTP調査」などがあります。
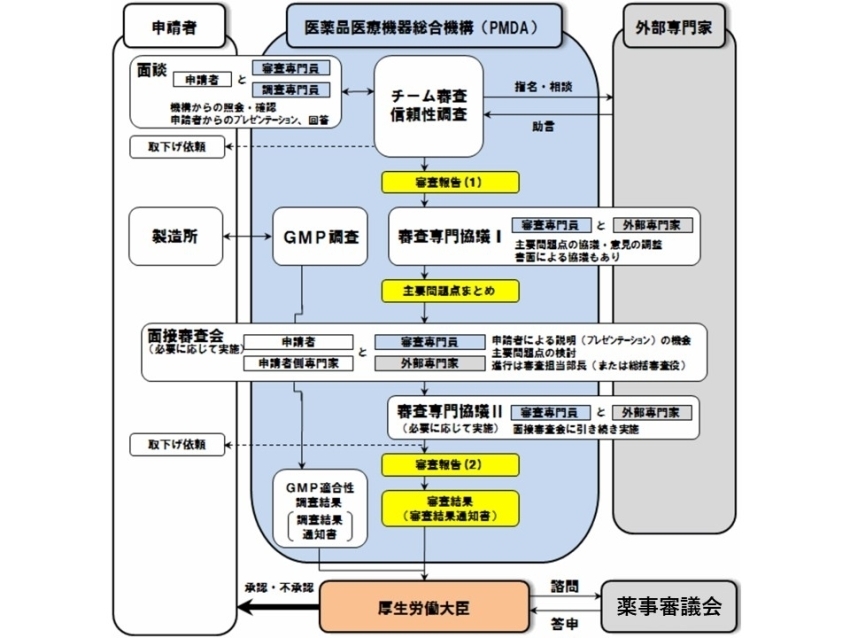
例:医薬品の承認審査業務のフローチャート
承認審査業務に関する取組み
- 先駆けパッケージ戦略への対応
- 医薬品の条件付き承認制度への対応
- 希少疾病等に用いる医薬品について海外においてのみ検証的な臨床試験が実施されている場合における日本人データに係る基本的考え方について(2024年(令和6年)10月23日付け事務連絡)[186KB]/English Version[88.48KB]
- 革新的医療機器条件付早期承認制度への対応
- 新医薬品審査業務における品質方針[145KB]
その他
各企業の利益相反確認担当者が変更した場合にはcoi_mhlwhb-pmda[at]pmda.go.jpにご連絡ください。
(迷惑メール防止対策をしているため、[at]を半角のアットマークに置き換えてください)
