PMDAでは、医薬品医療機器法施行規則に基づき、検定・検査機関の1つとして検定告示(昭和38年厚生省公示第279号)に示す生物学的製剤(ワクチン、血液製剤など)の品質管理を行っております。
(その他の生物学的製剤は、国立健康危機管理研究機構(JIHS)が品質管理を行っております)
PMDAで行った検定・検査に合格した医薬品について、公表しております。
検定・検査の流れについて
検定・検査の申請から合格通知の発出までの大まかな流れをお示しします。
なお、標準的な事務処理期間は厚生労働省のHP(医薬品等の検定についてhttp://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/kentei_ikou/index.html)をご確認ください。
注:PMDAが品質管理を行う品目であっても、試験品は国立健康危機管理研究機構(JIHS)への送付をお願いします。(JIHSのURLは「5.関連リンク」の項に示します)
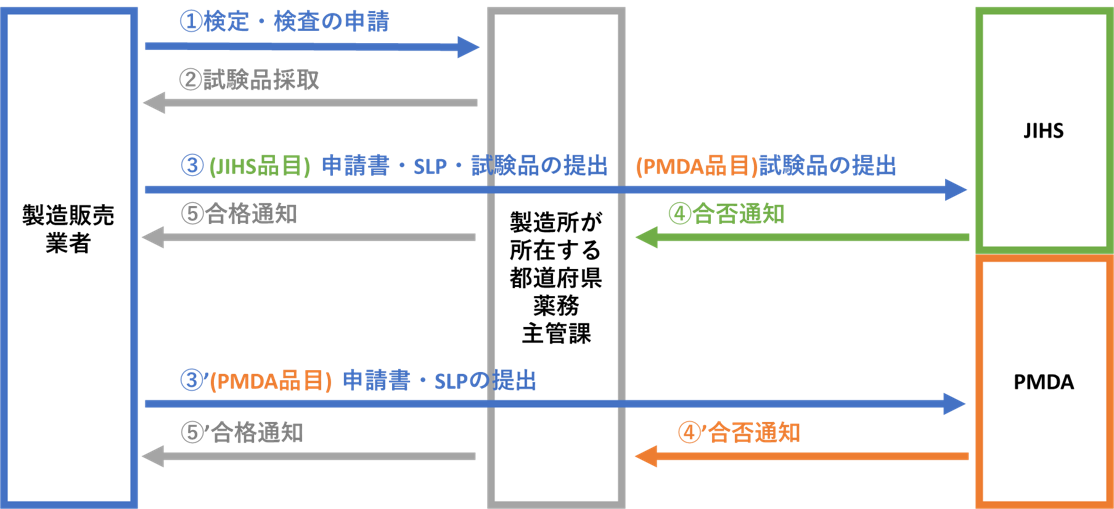
検定・検査の申請にあたって提出すべき資料について
下記の事務連絡にしたがい、都道府県薬務主管課に申請後、以下の資料を電子媒体としてゲートウェイのFD様式外機能を用いてPMDAに直接提出してください。
- 事務連絡(令和7年10月1日)[373KB]
- 検定申請書(事務連絡別紙様式1)[34.9KB]
- 製造・試験記録等要約書(以下「SLP」という。)
- 当該品目に係る承認書の写し(前回の検定の申請時に提出したものから変更がない場合を除く。)
- 当該品目に係る外国製造業者が作成した、製造記録等を記録した文書(参考資料として添付する場合。)
- 金融機関が発行した振込記録(振込明細書等。複数ロット分を同時に振り込む場合には手数料内訳表(事務連絡別紙様式2)[32.1KB]も添付してください。)
- 申請チェックリスト(事務連絡別紙様式3)[29.1KB]
ゲートウェイのFD様式外機能を用いた提出を行う際は、以下の手順において【共通】及び【検定・検査の申請】の項を参照してください。
検定・検査の申請手数料について
検定・検査の申請手数料は、検定告示(昭和38年厚生省公示第279号)に示すとおりです。
| 銀行名 | 支店名 | 預金種別 | 口座番号 | 口座名義 | 口座カナ |
|---|---|---|---|---|---|
| みずほ銀行 | 新橋支店 | 普通預金 | 4293167 | 独立行政法人医薬品医療機器総合機構 | ドク)イヤクヒンイリョウキキソウゴウキコウ |
注1:原則、1申請につき1振込として下さい。 複数ロット分を同時に振り込む場合には、手数料内訳表(事務連絡別紙様式2)も申請資料に添付してください。
注2:原則、振込残額を、他の申請の手数料に振り替えることはできません。振込残額が発生しないよう、正しい金額を振り込んでください。
(申請Aの振込残額と申請Bの振込残額を合算して申請Cの手数料とすることは出来ません)
翌月の出検予定の連絡について
毎月20日までに、翌月の出検予定を電子メールでご提出ください。電子メールの宛先等は下記の事務連絡の4.資料の提出方法についてをご参照ください。
SLP様式の作成及び変更等の申請について
PMDAが検定・検査を行う品目について、SLP様式の変更等の申請先はPMDAとなります。
(新たに承認される品目に関するSLP様式の作成者については、厚生労働省 医薬局 監視指導・麻薬対策課にご確認ください。)
下記の事務連絡にしたがい、以下の資料各1部を紙媒体(各1部)及び電子媒体として、それぞれ郵送及びゲートウェイのFD様式外機能を用いてPMDAに直接提出してください。
- 事務連絡(令和7年10月1日)[373KB]
- 製造・試験記録等要約書の様式作成申請書(事務連絡別紙様式4)[26.1KB]又は製造・試験記録等要約書の様式変更(確認)申請書(事務連絡別紙様式5)[26.6KB]
- SLP様式の案
- 医薬品製造販売承認(申請)書
- コモン・テクニカル・ドキュメント(CTD) 2.3
郵送先は以下のとおりです。
〒100-0013
東京都千代田区霞が関3-3-2 新霞が関ビル
独立行政法人 医薬品医療機器総合機構 医薬品品質管理部 検定・検査課
TEL:03-3506-9446
ゲートウェイのFD様式外機能を用いた提出を行う際は、以下の手順において【共通】及び【SLP審査様式の作成及び変更の申請】の項を参照してください。
関連リンク
- 厚生労働省:医薬品等の検定について
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/kentei_ikou/index.html - 国立健康危機管理研究機構(JIHS)検定検査情報
https://www.niid.jihs.go.jp/content2/certification/20250325183001.html
