2023年5月8日以降、このページは更新しておりません。個別の製品の最新情報については、情報検索のページをご覧ください。
関連製品の承認審査について
- 新型コロナウイルス感染症又は関連する症状を対象とする医薬品、医薬部外品、医療機器、体外診断用医薬品及び再生医療等製品については、下記の関連事務連絡等に基づき優先審査を行うこととされています。
- PMDAにおいても、開発の早期の段階から関係者からの相談に応じるなど、関連製品の開発が円滑に進むよう取り組んでいるところです。
- また、関連製品の承認申請がなされた際には、できる限り迅速に審査を進めることとしております。
| 発出日 | 発出者 | 文書名 | ||
|---|---|---|---|---|
| 1 (廃止) |
R2.3.19 | 厚生労働省医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 新型コロナウイルス感染症に係る治験の計画の届出等に関する取扱いについて |  |
| 2 (廃止) |
R2.3.27 | (独)医薬品医療機器総合機構 | 新型コロナウイルス感染症の影響下での医薬品、医療機器及び再生医療等製品の治験実施に係るQ&A |  |
| 3 (廃止) |
R2.4.1 | 厚生労働省医政局研究開発振興課・医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 新型コロナウイルス感染症に係る治験に関する審査委員会での審査の取扱いについて |  |
| 4 | R2.4.7 | 厚生労働省医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 治験における同意文書の保存に関する取扱いについて |  |
| 5 (廃止) |
R2.4.13 | 厚生労働省医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 新型コロナウイルス感染症の発生に伴う当面の医薬品、医療機器、体外診断用医薬品及び再生医療等製品の承認審査に関する取扱いについて |  |
| 6 (廃止) |
R2.4.13 | 厚生労働省医薬・生活衛生局医療機器審査管理課・監視指導・麻薬対策課 | 新型コロナウイルス感染症に係る人工呼吸器等の医療機器の承認審査等に関する取扱いについて |  |
| 7 (廃止) |
R2.4.16 | 厚生労働省医政局総務課医療安全推進室 等 | 新型コロナウイルス感染症の拡大を踏まえた製造販売業者における人工呼吸器の単回使用構成品の例外的取扱いについて |  |
| 8 (廃止) |
R2.4.21 | 厚生労働省医政局総務課医療安全推進室 等 | 新型コロナウイルス感染症の拡大を踏まえた医療機関等における人工呼吸器の単回使用構成品の例外的取扱いについて |  |
| 9 (廃止) |
R2.4.24 | 厚生労働省医薬・生活衛生局医薬品審査管理課 | 新型コロナウイルス感染症の発生に伴う当面の新指定医薬部外品たる外皮消毒剤の承認審査に関する取扱いについて |  |
| 10 (廃止) |
R2.5.12 | 厚生労働省医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 新型コロナウイルス感染症に対する医薬品等の承認審査上の取扱いについて |  |
| 11 (廃止) |
R2.5.12 | 厚生労働省医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 新型コロナウイルス感染症の発生に伴う当面の適合性書面調査及びGCP実地調査の実施要領に関する取扱いについて |  |
| 12 | R2.9.2 | (独)医薬品医療機器総合機構 ワクチン等審査部 | 新型コロナウイルス(SARS-CoV-2)ワクチンの評価に関する考え方 |  |
| 13 (廃止) |
R2.10.1 | (独)医薬品医療機器総合機構 | 新型コロナウイルスワクチン戦略相談(無料)の新設について | 掲載ページ |
| 14 | R2.12.9 | (独)医薬品医療機器総合機構 一般薬等審査部 | 新指定医薬部外品(外皮消毒剤)を申請する際の留意事項について | 掲載ページ |
| 15 | R3.4.5 | (独)医薬品医療機器総合機構 ワクチン等審査部 | 新型コロナウイルス(SARS-CoV-2)ワクチンの評価に関する考え方(補遺1)変異株に対するワクチンの評価について |  |
| 16 | R3.6.11 | (独)医薬品医療機器総合機構 ワクチン等審査部 | 新型コロナウイルス(SARS-CoV-2)ワクチンの評価に関する考え方(補遺2)プラセボ対照試験の被験者等に対する倫理的配慮について |  |
| 17 (廃止) |
R3.6.17 | 厚生労働省医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 新型コロナウイルス感染症に対する医薬品等の承認審査上の取扱いについて(その2) |  |
| 18 | R3.9.27 | 厚生労働省新型コロナウイルス感染症対策推進本部 厚生労働省医薬・生活衛生局総務課 |
新型コロナウイルス感染症流行下における薬局での医療用抗原検査キットの取扱いについて |  |
| 19 | R3.10.22 | (独)医薬品医療機器総合機構 ワクチン等審査部 | 新型コロナウイルス(SARS-CoV-2)ワクチンの評価に関する考え方(補遺3)免疫原性に基づく新型コロナウイルスワクチンの評価の考え方 |  |
| 20 | R4.2.9 | 厚生労働省医薬・生活衛生局医薬品審査管理課 | 新型コロナウイルス治療薬の治験広告に係るIRBの取扱いについて |  |
| 21 | R4.5.20 | 厚生労働省医薬・生活衛生局医薬品審査管理課・医療機器審査管理課 | 「新型コロナウイルス感染症に対する医薬品等の承認審査上の取扱いについて」の廃止について |  |
| 22 | R4.7.15 | (独)医薬品医療機器総合機構 ワクチン等審査部 | 新型コロナウイルス(SARS-CoV-2)ワクチンの評価に関する考え方(補遺4)親ワクチンを改変した変異株ワクチン及び新たな有効成分を用いた追加接種用ワクチンの免疫原性に基づく評価について |  |
| 23 | R4.8.17 | 厚生労働省医薬・生活衛生局医療機器審査管理課 | 一般用新型コロナウイルス抗原定性検査キットに係る製造販売承認申請の取扱いについて |  |
| 24 | R4.11.29 | 厚生労働省医薬・生活衛生局医療機器審査管理課 | 一般用 SARS コロナウイルス抗原・インフルエンザウイルス抗原キットに係る一般用検査薬の製造販売承認申請の取扱いについて |  |
関連製品の承認情報
令和2年3月以降にPMDAが審査を行い厚生労働省が承認した関連製品の一覧は以下のとおりです。
なお、承認審査中及び承認申請前(開発中)の製品に係る情報については、当機構からお答えすることができないため、申請者(製薬企業等)にお問い合わせください。
医薬品
<治療薬>
| 一般名 | 販売名 | 製造販売業者 | 添付文書等 | 承認日 |
|---|---|---|---|---|
| レムデシビル | ベクルリー点滴静注用100mg | ギリアド・サイエンシズ株式会社 | 添付文書 留意事項通知 特例承認に係る報告書 特例承認に係る報告書の正誤表 承認条件に係る評価報告書 |
2020年5月7日 (医薬品医療機器法第14条の3に基づく特例承認) |
| バリシチニブ | オルミエント錠4mg/同錠2mg | 日本イーライリリー株式会社 | 添付文書 審査報告書 |
2021年4月23日 |
| カシリビマブ(遺伝子組換え)及びイムデビマブ(遺伝子組換え) | ロナプリーブ注射液セット300/同注射液セット1332 | 中外製薬株式会社 | 添付文書 特例承認に係る報告書(2021年7月19日) 特例承認に係る報告書(2021年11月5日) |
2021年7月19日 2021年11月5日 (医薬品医療機器法第14条の3に基づく特例承認) |
| ソトロビマブ(遺伝子組み換え) | ゼビュディ点滴静注液500mg | グラクソ・スミスクライン株式会社 | 添付文書 特例承認に係る報告書 特例承認に係る報告書の正誤表 |
2021年9月27日 (医薬品医療機器法第14条の3に基づく特例承認) |
| モルヌピラビル | ラゲブリオカプセル200mg | MSD株式会社 | 添付文書 特例承認に係る報告書 |
2021年12月24日 (医薬品医療機器法第14条の3に基づく特例承認) |
| トシリズマブ(遺伝子組換え) | アクテムラ点滴静注用80mg/同点滴静注用200mg/同点滴静注用400mg | 中外製薬株式会社 | 添付文書 審査報告書 |
2022年1月21日 |
| ニルマトレルビル、リトナビル | パキロビッドパック | ファイザー株式会社 | 添付文書 特例承認に係る報告書 |
2022年2月10日(医薬品医療機器法第14条の3に基づく特例承認) |
| チキサゲビマブ(遺伝子組換え)、シルガビマブ(遺伝子組換え) | エバシェルド筋注セット | アストラゼネカ株式会社 | 添付文書 特例承認にかかる報告書 |
2022年8月30日(医薬品医療機器法第14条の3に基づく特例承認) |
| エンシトレルビル フマル酸 | ゾコーバ錠125mg | 塩野義製薬株式会社 | 添付文書 審査報告書 |
2022年11月22日(医薬品医療機器法第14条の2の2に基づく緊急承認) |
<ワクチン>
| 一般名 | 販売名 | 製造販売業者 | 添付文書等 | 承認日 |
|---|---|---|---|---|
| コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2) | コミナティ筋注 | ファイザー株式会社 | 添付文書(1価:起源株) 留意事項通知 留意項通知の補遺 特例承認に係る報告書(2021年2月14日) 特例承認に係る報告書(2021年11月11日) |
2021年2月14日 2021年11月11日 (医薬品医療機器法第14条の3に基づく特例承認) |
| コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2) | コミナティ筋注5~11歳用 | ファイザー株式会社 | 添付文書(1価:起源株) 添付文書(2価:起源株/オミクロン株BA.4-5) 特例承認に係る報告書(2022年1月21日) 特例承認に係る報告書(2022年8月30日) 特例承認に係る報告書(2022年8月30日)の正誤表 特例承認に係る報告書(2023年2月28日) |
2022年1月21日 2022年8月30日 2023年2月28日 (医薬品医療機器法第14条の3に基づく特例承認) |
| コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2) | コミナティ筋注6ヵ月~4歳用 | ファイザー株式会社 | 添付文書(1価:起源株) 特例承認に係る報告書(2022年10月5日) 製造販売後の副反応発現状況※2 |
2022年10月5日 (医薬品医療機器法第14条の3に基づく特例承認) |
| コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2) | コミナティRTU筋注 | ファイザー株式会社 | 添付文書(2価:起源株/オミクロン株BA.1) 添付文書(2価:起源株/オミクロン株BA.4-5) 特例承認に係る報告書(2022年9月12日) 特例承認に係る報告書(2022年9月12日)の正誤表 製造販売後の副反応発現状況※2 |
2022年9月12日 2022年10月5日 (医薬品医療機器法第14条の3に基づく特例承認) |
| コロナウイルス修飾ウリジンRNA ワクチン(SARS-CoV-2) | スパイクバックス筋注 | モデルナ・ジャパン株式会社※1 | 添付文書(1価:起源株) 添付文書(2価:起源株/オミクロン株BA.1) 添付文書(2価:起源株/オミクロン株BA.4-5) 留意事項通知 留意事項通知の補遺 特例承認に係る報告書(2021年5月21日) 特例承認に係る報告書(2021年12月16日) 特例承認に係る報告書(2022年9月12日) 特例承認に係る報告書(2022年9月12日)の正誤表 製造販売後の副反応発現状況※3 |
2021年5月21日 2021年12月16日 2022年9月12日 2022年11月1日 (医薬品医療機器法第14条の3に基づく特例承認) |
| コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベクター) | バキスゼブリア筋注 | アストラゼネカ株式会社 | 添付文書 留意事項通知 特例承認に係る報告書(2021年5月21日) |
2021年5月21日 (医薬品医療機器法第14条の3に基づく特例承認) (2024年5月27日承認整理) |
| 組換えコロナウイルス(SARS-CoV-2)ワクチン | ヌバキソビッド筋注 | 武田薬品工業株式会社 | 添付文書 審査報告書 |
2022年4月19日 |
| コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えアデノウイルスベクター) | ジェコビデン筋注 | ヤンセンファーマ株式会社 | 審査報告書 審査報告書の正誤表 |
2022年6月20日 (2023年6月30日承認整理) |
※1 2022年8月1日に武田薬品工業株式会社より承継。
※2 医薬品リスク管理計画書(RMP)の追加のリスク最小化活動として副反応発現状況の定期的な公表を行っています。リンク先はファイザー株式会社の提供する情報サイト(ファイザー新型コロナウイルスワクチン医療従事者専用サイト)になります。当該情報サイトの「製品情報」をご参照ください。なお、当該情報サイトの掲載内容に関するお問い合わせ等については、製造販売業者へお願いします。
※3 医薬品リスク管理計画書(RMP)の追加のリスク最小化活動として副反応発現状況の定期的な公表を行っています。リンク先はモデルナ・ジャパン株式会社の提供する情報サイト(医療従事者の方へ)になります。当該情報サイトの「製品情報」をご参照ください。なお、当該情報サイトの掲載内容に関するお問い合わせ等については、製造販売業者へお願いします。
医療機器
| 一般名 | 販売名 | 製造販売業者 | 添付文書等※1 | 承認日 |
|---|---|---|---|---|
| 汎用人工呼吸器 | NKV-550シリーズ人工呼吸器 | 日本光電工業株式会社 | 添付文書 | 2020年4月24日 |
| 二相式気道陽圧ユニット | E30 システム | 株式会社フィリップス・ジャパン | 添付文書 | 2020年5月1日 |
| 成人用人工呼吸器 | トリロジー EVOシリーズ | 株式会社フィリップス・ジャパン | 添付文書 | 2020年5月12日 |
| X線画像診断装置ワークステーション用プログラム | COVID-19肺画像解析AIプログラム InferRead CT Pneumonia | 株式会社CESデカルト | 添付文書 審査概要 |
2020年6月3日 |
| 成人用人工呼吸器 | ピューリタンベネット 560 | コヴィディエンジャパン株式会社 | 添付文書 | 2020年6月12日 |
| 成人用人工呼吸器 | アコマ人工呼吸器ART-21EX | アコマ医科工業株式会社 | 添付文書 | 2020年6月19日 |
| ヘパリン使用大動脈カニューレ | NSHヘパリン化カニューレ | 泉工医科工業株式会社 | 添付文書 | 2020年6月25日 |
| X線画像診断装置ワークステーション用プログラム | COVID-19肺炎画像解析プログラム Ali-M3 | 株式会社MICメディカル | 添付文書 審査概要 |
2020年6月29日 |
| 人工心肺用システム | 人工心肺装置 S5 | LivaNova Deutschland GmbH (選任製造販売業者:リヴァノヴァ株式会社) |
添付文書 | 2020年7月13日 |
| 重要パラメータ付き多項目モニタ | 生体情報モニタ IntelliVue MX850/750 | 株式会社フィリップス・ジャパン | 添付文書 | 2020年7月31日 |
| 汎用人工呼吸器 | Evita Vシリーズ | ドレーゲルジャパン株式会社 | 添付文書 | 2020年9月14日 |
| 新生児・小児用人工呼吸器 | Babylog VNシリーズ | ドレーゲルジャパン株式会社 | 添付文書 | 2020年9月14日 |
| 重要パラメータ付き多項目モニタ | 生体情報モニタ IntelliVue | 株式会社フィリップス・ジャパン | 添付文書 | 2020年9月17日 |
| 解析機能付きセントラルモニタ用プログラム | セントラルモニタ フィリップスインフォメーションセンタ | 株式会社フィリップス・ジャパン | 添付文書 | 2020年11月4日 |
| 汎用人工呼吸器 | ベンチレータ PB980シリーズ | コヴィディエンジャパン株式会社 | 添付文書 | 2021年1月8日 |
| 汎用針付注射筒 | トップシリンジMV | 株式会社トップ | 添付文書 | 2021年2月10日 |
| 汎用針付注射筒 | FNシリンジ | テルモ株式会社 | 添付文書 | 2021年3月5日 |
| 汎用針付注射筒 | ニプロVAシリンジ | ニプロ株式会社 | 添付文書 | 2021年3月25日 |
| 汎用針付注射筒 | LDSシリンジ | スミスメディカル・ジャパン株式会社 | 添付文書 | 2021年5月20日 |
| 汎用画像診断装置ワークステーション用プログラム | COVID-19肺炎画像解析プログラム FS-AI693型 | 富士フイルム株式会社 | 添付文書 審査概要 |
2021年5月26日 |
| 単回使用ガス式肺人工蘇生器 | マイクロベント V3 (MicroVent V3) | 株式会社ニュートン | 添付文書 | 2021年6月24日 |
| 成人用人工呼吸器 | elisa ベンチレータ 300/500 | アイ・エム・アイ株式会社 | 添付文書 | 2021年7月1日 |
| 汎用輸液ポンプ | カフティーポンプS | エア・ウォーター株式会社 | 添付文書 | 2021年7月7日 |
| 汎用針付注射筒 | JMS予防接種用針埋込型シリンジ | 株式会社ジェイ・エム・エス | 添付文書 | 2021年11月16日 |
| X線画像診断装置ワークステーション用プログラム | 胸部X線肺炎検出エンジン DoctorNet JLK-CRP | 株式会社ドクターネット | 添付文書 審査概要 |
2021年12月9日 |
| X線画像診断装置ワークステーション用プログラム | HOPE LifeMark-CAD 肺炎画像解析支援プログラム for COVID-19 | 富士通Japan株式会社 | 添付文書 審査概要 |
2021年12月24日 |
| X線画像診断装置ワークステーション用プログラム | COVID-19肺炎解析ソフトウェア SCO-PA01 | キヤノンメディカルシステムズ株式会社 | 添付文書 審査概要 |
2022年6月2日 |
| 汎用人工呼吸器 | サーボベンチレータシステム | フクダ電子株式会社 | 添付文書 | 2022年12月15日 |
※1 審査概要は承認条件を付与したもののみ掲載
体外診断用医薬品
| 一般名 | 販売名 | 製造販売業者 | 添付文書等 | 承認日 |
|---|---|---|---|---|
| SARSコロナウイルス核酸キット | 2019−nCoV検出蛍光リアルタイムRT−PCRキット | シスメックス株式会社 | 添付文書 審査概要 |
2020年3月27日 |
| SARSコロナウイルス核酸キット | Loopamp 新型コロナウイルス2019(SARS-CoV-2)検出試薬キット | 栄研化学株式会社 | 添付文書 審査概要 |
2020年3月31日 |
| SARSコロナウイルス核酸キット | コバス SARS-CoV-2 | ロシュ・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2020年4月7日 |
| SARSコロナウイルス核酸キット | TaqPath 新型コロナウイルス(SARS-CoV-2) リアルタイムPCR検出キット | ライフテクノロジーズジャパン株式会社 | 添付文書 審査概要 |
2020年4月20日 |
| SARSコロナウイルス核酸キット | Xpert Xpress SARS-CoV-2「セフィエド」 | ベックマン・コールター株式会社 | 添付文書 審査概要 |
2020年5月8日 |
| SARSコロナウイルス抗原キット | エスプライン SARS-CoV-2 | 富士レビオ株式会社 | 添付文書 審査概要 |
2020年5月13日 |
| SARSコロナウイルス核酸キット | MEBRIGHT SARS-CoV-2 キット | 株式会社医学生物学研究所 | 添付文書 審査概要 |
2020年5月21日 |
| SARSコロナウイルス核酸キット 核酸同定・ウイルスキット 核酸同定・一般細菌キット |
FilmArray呼吸器パネル2.1 | ビオメリュー・ジャパン株式会社 | 添付文書 審査概要 |
2020年6月2日 |
| SARSコロナウイルス抗原キット | ルミパルスSARS-CoV-2 Ag | 富士レビオ株式会社 | 添付文書 審査概要 |
2020年6月19日 |
| SARSコロナウイルス核酸キット | ジーンキューブSARS-CoV-2 | 東洋紡株式会社 | 添付文書 審査概要 |
2020年7月2日 |
| SARSコロナウイルス核酸キット | 2019新型コロナウイルス RNA 検出試薬 TRCReady SARS-CoV-2 | 東ソー株式会社 | 添付文書 審査概要 |
2020年7月31日 |
| SARSコロナウイルス抗原キット |
クイックナビ-COVID19 Ag | デンカ株式会社 | 添付文書 審査概要 |
2020年8月11日 |
| SARSコロナウイルス核酸キット | SmartAmp新型コロナウイルス2019(SARS-CoV-2)検出試薬キット | ダナフォーム株式会社 | 審査概要 | 2020年8月17日 |
| SARSコロナウイルス核酸キット | アプティマ SARS-CoV-2 | ホロジックジャパン株式会社 | 添付文書 審査概要 |
2020年8月18日 |
| SARSコロナウイルス核酸キット | Ampdirect 2019-nCoV検出キット | 株式会社島津製作所 | 添付文書 審査概要 |
2020年9月8日 |
| SARSコロナウイルス核酸キット | アイデンシーパック SARS-CoV-2 | 株式会社アークレイ ファクトリー | 添付文書 審査概要 |
2020年9月8日 |
| SARSコロナウイルス抗原キット | イムノエースSARS-CoV-2/ キャピリア SARS-CoV-2 |
株式会社タウンズ | 添付文書 審査概要 |
2020年10月13日 |
| SARSコロナウイルス抗原キット | ルミパルスプレストSARS-CoV-2 Ag | 富士レビオ株式会社 | 添付文書 審査概要 |
2020年10月16日 |
| SARSコロナウイルス核酸キット | ID NOW 新型コロナウイルス2019 | アボット ダイアグノスティックス メディカル株式会社 | 添付文書 審査概要 |
2020年10月20日 |
| SARSコロナウイルス核酸キット | ジーンキューブHQ SARS-CoV-2 | 東洋紡株式会社 | 添付文書 審査概要 |
2020年10月23日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット |
SGNP nCoV/Flu PCR検出キット | 株式会社スディックスバイオテック | 添付文書 審査概要 |
2020年10月23日 |
| SARSコロナウイルス核酸キット | Takara SARS-CoV-2 ダイレクトPCR検出キット | タカラバイオ株式会社 | 添付文書 審査概要 |
2020年10月27日 |
| インフルエンザウイルスキット | ルミパルス Flu-A&B | 富士レビオ株式会社 | 添付文書 審査概要 |
2020年11月10日 |
| SARSコロナウイルス抗原キット | HISCL SARS-CoV-2 Ag 試薬 | シスメックス株式会社 | 添付文書 審査概要 |
2020年11月10日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット |
コバス SARS-CoV-2 & Flu A/B | ロシュ・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2020年11月13日 |
| SARSコロナウイルス核酸キット | Illumina COVIDSeq テスト | イルミナ株式会社 | 添付文書 審査概要 |
2020年12月8日 |
| SARSコロナウイルス抗原キット | SARSコロナウイルス抗原キットRapiimSARS-CoV-2-N PRT-C2N01A | キヤノンメディカルシステムズ株式会社 | 添付文書 審査概要 |
2020年12月8日 |
| SARSコロナウイルス核酸キット | TaqPath SARS-CoV-2 リアルタイムPCR検出キット HT | ライフテクノロジーズジャパン株式会社 | 添付文書 審査概要 |
2020年12月17日 |
| インフルエンザウイルス核酸キット | ジーンキューブ Flu A/B | 東洋紡株式会社 | 添付文書 審査概要 |
2020年12月21日 |
| インフルエンザウイルスキット | ルミパルスプレスト Flu-A&B | 富士レビオ株式会社 | 添付文書 審査概要 |
2020年12月22日 |
| インターフェロン-λ3キット | HISCL IFN-λ3 試薬 | シスメックス株式会社 | 添付文書 審査概要 |
2020年12月22日 |
| SARSコロナウイルス核酸キット | 2019 新型コロナウイルス RNA 検出試薬 TRCReady SARS CoV 2 i | 東ソー株式会社 | 添付文書 審査概要 |
2021年1月19日 |
| SARSコロナウイルス抗原キット | ルミラ・SARS-CoV-2 Ag テストストリップ | ルミラ・ダイアグノスティクス・ジャパン株式会社 | 添付文書 審査概要 |
2021年1月19日 |
| SARSコロナウイルス抗原キット | Panbio COVID-19 Antigen ラピッド テスト | アボット ダイアグノスティクス メディカル株式会社 | 添付文書 審査概要 |
2021年1月22日 |
| SARSコロナウイルス抗原キット | BD ベリター SARS-CoV-2 コロナウイルス抗原キット | 日本ベクトン・ディッキンソン株式会社 | 添付文書 審査概要 |
2021年1月26日 |
| SARSコロナウイルス抗原キット | プロラスト SARS-CoV-2 Ag アドテスト SARS-CoV-2 |
アドテック株式会社 | 添付文書 審査概要 |
2021年1月29日 |
| インフルエンザウイルス核酸キット | Loopamp B型インフルエンザウイルス検出試薬キット | 栄研化学株式会社 | 添付文書 審査概要 |
2021年2月2日 |
| SARSコロナウイルス抗原キット | SARS-CoV-2 ラピッド抗原テスト | ロシュ・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2021年2月9日 |
| SARSコロナウイルス核酸キット | Simprova 呼吸器ウイルスパネル SARS-CoV-2 | 栄研化学株式会社 | 添付文書 審査概要 |
2021年2月15日 |
| SARSコロナウイルス核酸キット | Takara SARS-CoV-2 & Flu ダイレクトPCR検出試薬キット | タカラバイオ株式会社 | 添付文書 審査概要 |
2021年2月15日 |
| SARSコロナウイルス抗原キット | 富士ドライケム IMMUNO AG ハンディ COVID-19 Ag | 富士フイルム株式会社 | 添付文書 審査概要 |
2021年2月15日 |
| インフルエンザウイルス核酸キット | Simprova呼吸器ウイルスパネルFluA | 栄研化学株式会社 | 添付文書 審査概要 |
2021年2月15日 |
| インフルエンザウイルス核酸キット | Simprova呼吸器ウイルスパネルFluB | 栄研化学株式会社 | 添付文書 審査概要 |
2021年2月15日 |
| SARSコロナウイルス核酸キット | スマートジーン SARS-CoV-2 | 株式会社 ミズホメディー | 添付文書 審査概要 |
2021年2月18日 |
| SARSコロナウイルス抗原キット | Sofia アナライザー用 SARS-CoV-2 FIA | Quidel Corporation | 添付文書 審査概要 |
2021年2月18日 |
| インフルエンザウイルスキット | HISCL インフルエンザ 試薬 | シスメックス株式会社 | 添付文書 審査概要 |
2021年2月18日 |
| SARSコロナウイルス核酸キット | Alinity m システム SARS-CoV-2 | アボットジャパン合同会社 | 添付文書 審査概要 |
2021年2月24日 |
| SARSコロナウイルス抗原キット | クイック チェイサー Auto SARS-CoV-2 | 株式会社 ミズホメディー | 添付文書 審査概要 |
2021年3月2日 |
| SARSコロナウイルス抗原キット | 富士ドライケム IMMUNO AG カートリッジ COVID-19 Ag | 株式会社 ミズホメディー | 添付文書 審査概要 |
2021年3月2日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット |
コバスLiat SARS-CoV-2 & Flu A/B | ロシュ・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2021年3月12日 |
| SARSコロナウイルス抗原キット | アルソニック COVID-19 Ag | アルフレッサ ファーマ株式会社 | 添付文書 審査概要 |
2021年3月12日 |
| SARSコロナウイルス抗原キット | KBM ラインチェック nCoV(スティックタイプ) | コージンバイオ株式会社 | 添付文書 審査概要 |
2021年3月17日 |
| SARSコロナウイルス抗原キット | エクルーシス試薬 SARS-CoV-2 Ag | ロシュ・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2021年3月17日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット |
Xpert Xpress SARS-CoV-2/Flu「セフィエド」 | ベックマン・コールター株式会社 | 添付文書 審査概要 |
2021年4月14日 |
| SARSコロナウイルス核酸キット | DetectAmp SARS-CoV-2 RT-PCRキット | シスメックス株式会社 | 添付文書 審査概要 |
2021年4月14日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
COVID-19 and Influenza A+B抗原コンボテスト「ニチレイバイオ」 | 株式会社ニチレイバイオサイエンス | 添付文書 審査概要 |
2021年4月14日 |
| SARSコロナウイルス抗原キット | イムノアロー SARS-CoV-2 | 東洋紡株式会社 | 添付文書 審査概要 |
2021年5月12日 |
| SARSコロナウイルス抗原キット | ビトロス SARS-CoV-2抗原 | オーソ・クリニカル・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2021年5月12日 |
| SARSコロナウイルス核酸キット | DELBio Dagene G1 新型コロナウイルス検出試薬キット | デルタ電子株式会社 | 添付文書 審査概要 |
2021年5月27日 |
| SARSコロナウイルス核酸キット | SGNP nCoV PCR 検出キット | スディックスバイオテック株式会社 | 添付文書 審査概要 |
2021年5月27日 |
| SARSコロナウイルス抗原キット | チェックMR-COV19 | ロート製薬株式会社 | 添付文書 審査概要 |
2021年5月27日 |
| SARSコロナウイルス核酸キット | スイフトジーンSARS-CoV-2「カイノス」 | 株式会社カイノス | 添付文書 審査概要 |
2021年5月31日 |
| SARSコロナウイルス核酸キット | TRexGene SARS-CoV-2検出キット | 東洋紡株式会社 | 添付文書 審査概要 |
2021年6月3日 |
| Th2ケモカイン・TARCキット | HISCL TARC 試薬 | 塩野義製薬株式会社 | 添付文書 審査概要 |
2021年6月7日 |
| SARSコロナウイルス抗原キット | ラピッドテスタSARS-CoV-2 | 積水メディカル株式会社 | 添付文書 審査概要 |
2021年6月9日 |
| SARSコロナウイルス抗原キット | AFIAS COVID-19抗原 テストカートリッジ | 東京貿易メディシス株式会社 | 添付文書 審査概要 |
2021年6月16日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
クイックナビ-Flu+COVID19 Ag | デンカ株式会社 | 添付文書 審査概要 |
2021年6月16日 |
| SARSコロナウイルス核酸キット | エリートMGB SARS-CoV-2 PCR検出キット | プレシジョン・システム・サイエンス株式会社 | 添付文書 審査概要 |
2021年6月21日 |
| SARSコロナウイルス核酸キット | カネカ Direct RT-PCR キット SARS-CoV-2 | 株式会社カネカ | 添付文書 審査概要 |
2021年6月25日 |
| インターロイキン-6 キット | ケミルミIL6 | シーメンスヘルスケア・ダイアグノスティクス株式会社 | 添付文書 審査概要 |
2021年7月2日 |
| SARSコロナウイルス抗原キット | スタンダードQ COVID-19 Ag | 株式会社マルコム | 添付文書 審査概要 |
2021年8月13日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
エスプライン SARS-CoV-2&Flu A+B | 富士レビオ株式会社 | 添付文書 審査概要 |
2021年8月13日 |
| SARSコロナウイルス抗原キット | クオンパスCOVID-19抗原検査キット | セルスペクト株式会社 | 添付文書 審査概要 |
2021年9月14日 |
| SARSコロナウイルス抗原キット | イムノファイン SARS-CoV-2 | 株式会社ニチレイバイオサイエンス | 添付文書 審査概要 |
2021年9月14日 |
| SARSコロナウイルス抗原キット | AIA-パックCL SARS-CoV-2-Ag | 東ソー株式会社 | 添付文書 審査概要 |
2021年9月14日 |
| SARSコロナウイルス抗原キット | イムノエースSARS-CoV-2 II キャピリアSARS-CoV-2 II |
株式会社タウンズ | 添付文書 審査概要 |
2021年11月8日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
KBM ラインチェックnCoV/Flu | コージンバイオ株式会社 | 添付文書 審査概要 |
2021年11月8日 |
| SARSコロナウイルス核酸キット | FTD SARS-CoV-2キット | シーメンスヘルスケア・ダイアグノスティクス株式会社 | 添付文書 審査概要 |
2021年11月17日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
クイック チェイサー SARS-CoV-2/Flu | 株式会社 ミズホメディー | 添付文書 審査概要 |
2021年11月17日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
クイック チェイサー SARS-CoV-2/Flu A,B | 株式会社 ミズホメディー | 添付文書 審査概要 |
2021年11月17日 |
| SARSコロナウイルス核酸キット | ミュータスワコーSARS-CoV-2 | 富士フイルム和光純薬株式会社 | 添付文書 審査概要 |
2021年11月30日 |
| SARSコロナウイルス抗原キット | アキュラシード SARS-CoV-2抗原 | 富士フイルム和光純薬株式会社 | 添付文書 審査概要 |
2021年11月30日 |
| インフルエンザウイルス核酸キット | スマートジーン Flu A, B | 株式会社 ミズホメディー | 添付文書 審査概要 |
2021年11月30日 |
| SARSコロナウイルス核酸キット | J-Bio 迅速PCRキット SARS-CoV-2 | 日本バイオテクノファーマ株式会社 | 添付文書 審査概要 |
2021年12月23日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット |
BD マックス SARS-CoV-2/Flu | 日本ベクトン・ディッキンソン株式会社 | 添付文書 審査概要 |
2022年1月31日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
イムノエース SARS-CoV-2/Flu/キャピリア SARS-CoV-2/Flu | 株式会社タウンズ | 添付文書 審査概要 |
2022年2月8日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
アドテスト SARS-CoV-2/Flu | アドテック株式会社 | 添付文書 審査概要 |
2022年2月8日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
プライマルスクリーン SARS-CoV-2/Flu | アドテック株式会社 | 審査概要 | 2022年2月8日 |
| SARSコロナウイルス抗原キット | GLINE-2019-nCoV Agキット | 株式会社医学生物学研究所 | 添付文書 審査概要 |
2022年2月10日 |
| SARSコロナウイルス抗原キット | Exdia EKテスト COVID-19 Ag | 栄研化学株式会社 | 添付文書 審査概要 |
2022年2月10日 |
| SARSコロナウイルス抗原キット | クリニテストCOVID-19 抗原迅速テスト | シーメンスヘルスケア・ダイアグノスティクス株式会社 | 添付文書 審査概要 |
2022年2月16日 |
| SARSコロナウイルス抗原キット | アドテスト SARS-CoV-2 NEO | アドテック株式会社 | 添付文書 審査概要 |
2022年2月24日 |
| SARSコロナウイルス核酸キット | GeneSoC SARS-CoV-2 N2検出キット | 杏林製薬株式会社 | 添付文書 審査概要 |
2022年3月2日 |
| SARSコロナウイルス抗原キット | COVID-19抗原テスト「ニチレイバイオ」 | 株式会社ニチレイバイオサイエンス | 添付文書 審査概要 |
2022年3月4日 |
| SARSコロナウイルス抗原キット | イムノエースSARS-CoV-2 Saliva/キャピリアSARS-CoV-2 Saliva | 株式会社タウンズ | 添付文書 審査概要 |
2022年3月17日 |
| SARSコロナウイルス抗原キット | HEALGEN COVID-19 抗原迅速テスト | タカラバイオ株式会社 | 添付文書 審査概要 |
2022年3月17日 |
| インフルエンザウイルスキット | Exdia EKテスト Influenza A+B | 栄研化学株式会社 | 添付文書 審査概要 |
2022年3月17日 |
| SARSコロナウイルス核酸キット | ルミラ・SARS-CoV-2 RNA STAR Complete | ルミラ・ダイアグノスティクス・ジャパン株式会社 | 添付文書 審査概要 |
2022年3月31日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
ルミラ・SARS-CoV-2 & Flu A/B テストストリップ | ルミラ・ダイアグノスティクス・ジャパン株式会社 | 添付文書 審査概要 |
2022年3月31日 |
| インターロイキン-6 キット | ルミパルスプレスト IL-6 | 富士レビオ株式会社 | 添付文書 審査概要 |
2022年3月31日 |
| SARSコロナウイルス核酸キット RSウイルス核酸キット |
ジーンキューブ HQ SARS-CoV-2/RSV | 東洋紡株式会社 | 添付文書 審査概要 |
2022年4月6日 |
| SARSコロナウイルス核酸キット | SARS-CoV-2 RNA検出試薬 LAMPdirect Genelyzer KIT | キヤノンメディカルシステムズ株式会社 | 添付文書 審査概要 |
2022年4月8日 |
| SARSコロナウイルス抗原キット | クイックチェイサー SARS-CoV-2 | 株式会社 ミズホメディー | 添付文書 審査概要 |
2022年4月19日 |
| SARSコロナウイルス抗原キット | カネカ イムノクロマト SARS-CoV-2 Ag | 株式会社カネカ | 添付文書 審査概要 |
2022年5月25日 |
| SARSコロナウイルス抗原キット | アンスペクトコーワSARS-CoV-2 | 株式会社医学生物学研究所 | 添付文書 審査概要 |
2022年6月1日 |
| SARSコロナウイルス抗原キット | エスプライン SARS-CoV-2 N | 富士レビオ株式会社 | 添付文書 審査概要 |
2022年6月7日 |
| SARSコロナウイルス抗原キット RSウイルスキット |
ラピッドテスタ RSV&SARS-CoV-2 | 積水メディカル株式会社 | 添付文書 審査概要 |
2022年7月1日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
ラピッドテスタ FLU&SARS-CoV-2 | 積水メディカル株式会社 | 添付文書 審査概要 |
2022年7月1日 |
| SARSコロナウイルス抗原キット | ケミルミ SARS-CoV-2Ag | シーメンスヘルスケア・ダイアグノスティクス株式会社 | 添付文書 審査概要 |
2022年7月1日 |
| SARSコロナウイルス抗原キット | KBM ラインチェック nCoV | コージンバイオ株式会社 | 添付文書 審査概要 |
2022年7月8日 |
| インフルエンザウイルス核酸キット | GeneSoC インフルエンザウイルスA/B 検出キット | 杏林製薬株式会社 | 添付文書 審査概要 |
2022年8月4日 |
| SARSコロナウイルス抗原キット RSウイルスキット |
クイック チェイサー SARS-CoV-2/RSV | 株式会社ミズホメディー | 審査概要 | 2022年8月10日 |
| SARSコロナウイルス抗原キット | Ⅴトラスト SARS-CoV-2 Ag | ニプロ株式会社 | 添付文書 審査概要 |
2022年8月18日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
SARS-CoV-2 & Flu A/B ラピッド抗原テスト | ロシュ・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2022年9月7日 |
| SARSコロナウイルス核酸キット | エリートMGB SARS‐CoV‐2 PLUS PCR検出キット | プレシジョン・システム・サイエンス株式会社 | 添付文書 審査概要 |
2022年9月14日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
GLINE-SARS-CoV-2&FluA+Bキット | 株式会社医学生物学研究所 | 添付文書 審査概要 |
2022年9月14日 |
| SARSコロナウイルス核酸キット | ID NOW 新型コロナウイルス2019 v2.0 | アボット ダイアグノスティックス メディカル株式会社 | 添付文書 審査概要 |
2022年9月22日 |
| SARSコロナウイルス核酸キット | LeaDEA VIASURE SARS-CoV-2 PCRキット | プレシジョン・システム・サイエンス株式会社 | 添付文書 審査概要 |
2022年10月6日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット RSウイルスキット |
イムノアロー SARS-CoV-2&FluA/B&RSV | 東洋紡株式会社 | 添付文書 審査概要 |
2022年10月11日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット |
コバス Liat SARS-CoV-2 & Flu A/B | ロシュ・ダイアグノスティックス株式会社 | 添付文書 審査概要 |
2022年10月25日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット |
TRexGene SARS-CoV-2 & FluA/B検出キット | 東洋紡株式会社 | 添付文書 審査概要 |
2022年11月8日 |
| SARSコロナウイルス抗原キット | テガルナスティック SARS-CoV-2 Ag | 藤永製薬株式会社 | 添付文書 審査概要 |
2022年11月29日 |
| インフルエンザウイルス核酸キット RSウイルス核酸キット |
コバス Liat Flu A/B & RSV | ロシュ・ダイアグノスティックス株式会社 | 審査概要 | 2022年12月2日 |
| SARSコロナウイルス核酸キット インフルエンザウイルス核酸キット RSウイルス核酸キット |
Xpert Xpress CoV-2/Flu/RSV plus「セフィエド」 | ベックマン・コールター株式会社 | 添付文書 審査概要 |
2022年12月26日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
クイック チェイサー Auto SARS-CoV-2/Flu | 株式会社 ミズホメディー | 添付文書 審査概要 |
2022年12月26日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
富士ドライケム IMMUNO AG カートリッジ COVID-19/Flu | 株式会社 ミズホメディー | 添付文書 審査概要 |
2022年12月26日 |
| SARSコロナウイルス抗原キット | BIOCREDIT Covid-19 抗原検査キットNasal | Rapigen, Inc. | 添付文書 審査概要 |
2023年1月12日 |
| SARSコロナウイルス抗原キット | SARS-CoV-2 ラピッド抗原テストII | ロシュ・ダイアグノスティックス株式会社 | 審査概要 | 2023年1月18日 |
| SARSコロナウイルス抗原キット インフルエンザウイルスキット |
SARSコロナウイルス抗原キット インフルエンザウイルスキット Rapiim SARS-CoV-2-N/Flu PRT-20101A | キヤノンメディカルシステムズ株式会社 | 添付文書 審査概要 |
2023年3月17日 |
| SARSコロナウイルス核酸キット | QIAstat-Dx 呼吸器感染症パネルカートリッジ | 株式会社キアゲン | 審査概要 | 2023年3月22日 |
| SARSコロナウイルス核酸キット | Whole In One SARS-CoV-2ダイレクト検出キット | 株式会社ニッポンジーン | 審査概要 | 2023年3月24日 |
| SARSコロナウイルス抗原キット | RTテスト イムノクロマト-SARS-CoV-2 | 日水製薬株式会社 | 審査概要 | 2023年3月24日 |
一般用医薬品(一般用検査薬)
<一般用SARSコロナウイルス抗原キット>
| 販売名 | 製造販売業者 | 検体種 | 承認日 |
|---|---|---|---|
| SARS-CoV-2ラピッド抗原テスト(一般用) | ロシュ・ダイアグノスティックス株式会社 | 鼻腔ぬぐい液 | 2022年8月24日 |
| クリニテストCOVID-19 抗原迅速テスト(一般用) | シーメンスヘルスケア・ダイアグノスティクス株式会社 | 鼻腔ぬぐい液 | 2022年8月26日 |
| HEALGEN COVID-19抗原迅速テスト(一般用) | タカラバイオ株式会社 | 鼻腔ぬぐい液 | 2022年8月30日 |
| アンスペクトコーワ SARS-CoV-2(一般用) | 株式会社医学生物学研究所 | 唾液 | 2022年9月5日 |
| エスプライン SARS-CoV-2 N(一般用) | 富士レビオ株式会社 | 鼻腔ぬぐい液・唾液 | 2022年10月17日 |
| Ⅴトラスト SARS-CoV-2 Ag(一般用) | ニプロ株式会社 | 鼻腔ぬぐい液 | 2022年10月18日 |
| Panbio COVID-19 Antigen ラピッド テスト(一般用) | アボット ダイアグノスティクス メディカル株式会社 | 鼻腔ぬぐい液 | 2022年10月18日 |
| アドテスト SARS-CoV-2 NEO(一般用) | アドテック株式会社 | 鼻腔ぬぐい液 | 2022年11月8日 |
| GLINE-2019-nCoV Agキット(一般用) | 株式会社医学生物学研究所 | 鼻腔ぬぐい液 | 2022年11月11日 |
| エスプライン SARS-CoV-2&Flu A+B(一般用) | 富士レビオ株式会社 | 鼻腔ぬぐい液 | 2022年12月5日 |
| アドテストSARS-CoV-2/Flu(一般用) | アドテック株式会社 | 鼻腔ぬぐい液 | 2022年12月22日 |
| GLINE-SARS-CoV-2&FluA+Bキット(一般用) | 株式会社医学生物学研究所 | 鼻腔ぬぐい液 | 2022年12月22日 |
| SARS-CoV-2 ラピッド抗原テストII(一般用) | ロシュ・ダイアグノスティックス株式会社 | 鼻腔ぬぐい液 | 2023年1月18日 |
| 富士ドライケム IMMUNO AG ハンディ COVID-19 Ag(一般用) | 富士フイルム株式会社 | 鼻腔ぬぐい液 | 2023年1月27日 |
| BIOCREDIT Covid-19 抗原検査キットNasal(一般用) | Rapigen, Inc. | 鼻腔ぬぐい液 | 2023年2月20日 |
| 富士ドライケム IMMUNO AG ハンディ COVID-19 Ag(一般用) | 富士フイルム株式会社 | 鼻腔ぬぐい液 | 2023年1月27日 |
| BIOCREDIT Covid-19 抗原検査キットNasal(一般用) | Rapigen, Inc. | 鼻腔ぬぐい液 | 2023年2月20日 |
| クオンパス COVID-19 抗原検査キット(一般用) | セルスペクト株式会社 | 鼻腔ぬぐい液 | 2023年3月17日 |
医薬品・医療機器等に関する安全性情報
医薬品の安全対策に関する情報
新型コロナウイルスに関する医薬品の安全対策に関する情報を医療機関向けに発信しています。なお、掲載内容に関する問い合わせ等については、情報提供元へお願いします。
| 発出日 | 発出者 | 表題 | |
|---|---|---|---|
| 1 | R3.8.3 | 厚生労働省健康局健康課予防接種室 | 新型コロナワクチンの間違い接種情報No.1及びNo.2について 別紙1:「新型コロナワクチンの間違い接種情報」No.1(使用済み注射器の再使用) 別紙2:「新型コロナワクチンの間違い接種情報」No.2(ワクチンの再希釈(ファイザー社ワクチンの場合)) |
| 2 | R3.11.10 | 厚生労働省健康局健康課予防接種室 | 新型コロナワクチンの間違い接種情報No.3について 別紙:「新型コロナワクチンの間違い接種情報」No.3(他のワクチンとの間違い接種) |
医療従事者からの新型コロナワクチン接種による予防接種後副反応疑い報告の方法は「医薬関係者からの報告」のページをご覧ください。
医療機器の安全対策に関する情報
新型コロナウイルスに関連した医療機器の安全対策に関する情報です。
| 発出日 | 発出者 | 文書名 | ||
|---|---|---|---|---|
| 1 | R2.12.21 | 厚生労働省医薬・生活衛生局医療機器審査管理課・医薬安全対策課 | 人工呼吸器と組み合せて使用する製品に関する自主点検等について |  |
体外診断用医薬品の安全対策に関する情報
新型コロナウイルスに関連した体外診断用医薬品の安全対策に関する情報です。
| 発出日 | 発出者 | 文書名 | ||
|---|---|---|---|---|
| 1 | R3.5.11 | 厚生労働省医薬・生活衛生局医療機器審査管理課・医薬安全対策課 | 新型コロナウイルス感染症に係る体外診断用医薬品の市販後における情報収集等の徹底について |  |
PMDA医療安全情報
新型コロナウイルス感染症の感染拡大に伴い、医療現場で人工呼吸器等を使用する機会が増えていることから、安全使用のために注意するポイントをまとめた「PMDA医療安全情報」を作成しています。
| No. | 発行年月 | タイトル | 1枚目のイメージ |
|---|---|---|---|
| 臨時号1 | 令和2年4月 | 再周知特集 その1(人工呼吸器等の取扱い時の注意について) |  |
| 臨時号2 | 令和2年4月 | 再周知特集 その2(気管チューブ等の取扱い時の注意について) |  |
| 29 | 令和2年4月 (改訂) 平成23年12月 |
セントラルモニタ、ベッドサイドモニタ等の取扱い時の注意について | 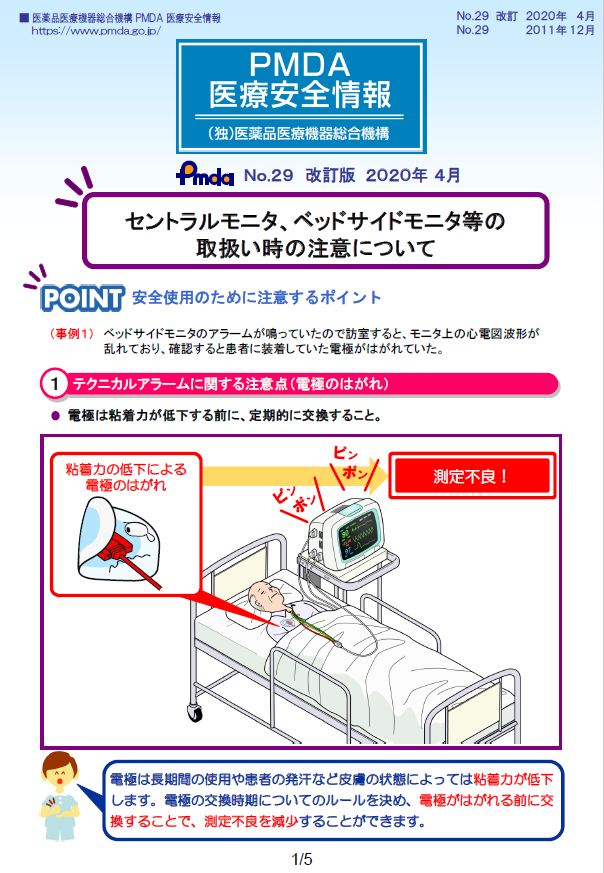 |
| 62 | 令和4年3月 | PCPS/ECMOカニューレの抜去事例について | 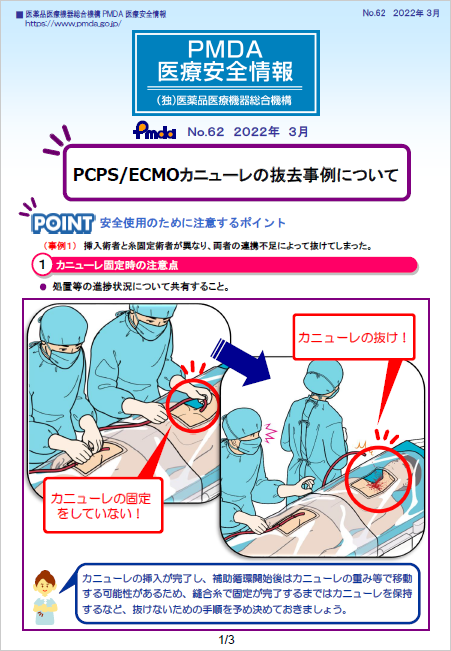 |
| 63 | 令和4年3月 | 人工呼吸器の使用前点検に関する注意について | 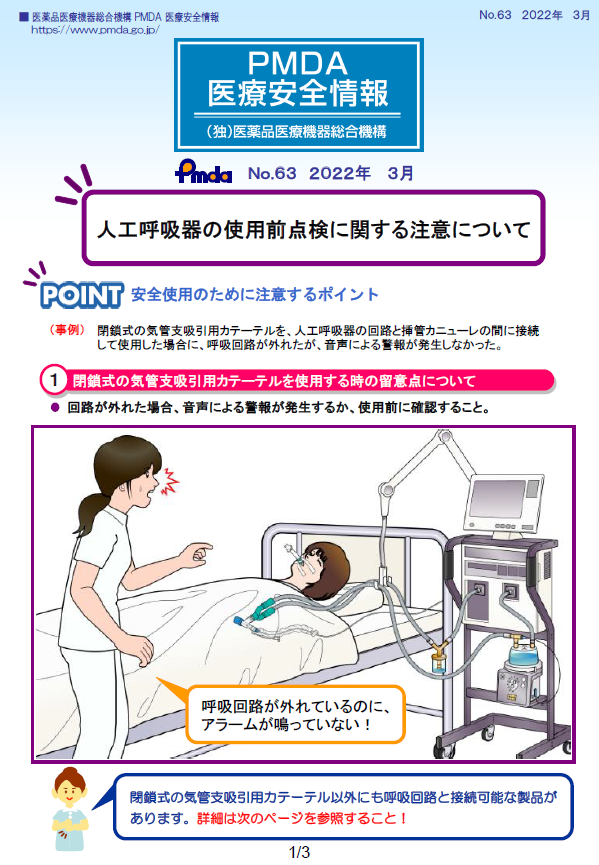 |
※PMDA医療安全情報の詳細についてはこちらのページをご覧ください。
国際的な活動情報
新型コロナウイルス感染症に対する医療製品の開発における規制上の考慮事項等について、ICMRA(薬事規制当局国際連携組織;International Coalition of Medicines Regulatory Authorities)の枠組みで議論を行っています。ICMRAは、規制当局による自発的、ハイレベルな支援組織であり、戦略的調整及び指導的な役割を担っている組織です。PMDAはICMRAの副議長を務めています。
