令和2年11月25日
独立行政法人 医薬品医療機器総合機構
1. 調査対象の範囲
公財)日本医療機能評価機構(以下、「評価機構」という。)による医療事故情報収集等事業報告書中の記述情報及び評価機構ホームページ上の公開データ中の医療機器に関連する医療事故及びヒヤリ・ハット事例
1)医療事故関係について
評価機構による医療事故情報収集等事業第59回及び第60回報告書(以下、「当該報告書」という。)中の記述情報及び評価機構ホームページ上の公開データから抽出した令和元年7月1日~12月31日の間に報告された事例。
2)ヒヤリ・ハット事例関係について
当該報告書中の記述情報から抽出した令和元年7月1日~12月31日の間に報告された事例。
3)その他
当該報告書中の記述情報から別途抽出した医療機器にかかる以下の事例。
- 中心静脈カテーテルのガイドワイヤーが体内に残存した事例
- 電気メスによる薬剤の引火
- はさみによるカテーテル・チューブの誤った切断
- 圧迫止血用パッド付絆創膏を長時間貼付し、褥瘡を形成した事例
- 2台の輸液ポンプを使用中、ルートの交差により流量を取違えた事例
- 経管栄養とインスリン投与に関連した事例
2. 検討方法
医療機器に起因するヒヤリ・ハット等の事例について、医療機器としての観点から安全対策に関する専門的な検討を行うため、各医療関係職能団体代表、学識経験者等の専門家及び製造販売業者の代表から構成される標記検討会を開催し、医療機器の物的要因に対する安全管理対策について検討した。
3. 調査結果
- 医療機器毎の事例数について
調査対象の各事例において使用されている医療機器毎に、各事例の報告者意見に基づく事故の内容及び事故の程度を分類し、まとめた結果を図3~図6、表1及び表2に示す。
また、表1及び表2においては、各医療機器におけるヒューマンエラー・ヒューマンファクターに起因する事例の事故の程度と内容の内訳を示している。尚、参考として過去2年分の調査対象の各事例において使用されているドレーン・チューブ及びドレーン・チューブ以外の医療機器における内訳を図1~図2に示す。
図1 調査対象の各事例において使用されているドレーン・チューブの内訳 ※赤線までの製品で全体の約6割を占めている。
集計対象期間:平成29年7月1日~平成30年6月30日 集計対象期間:平成30年7月1日~令和元年6月30日
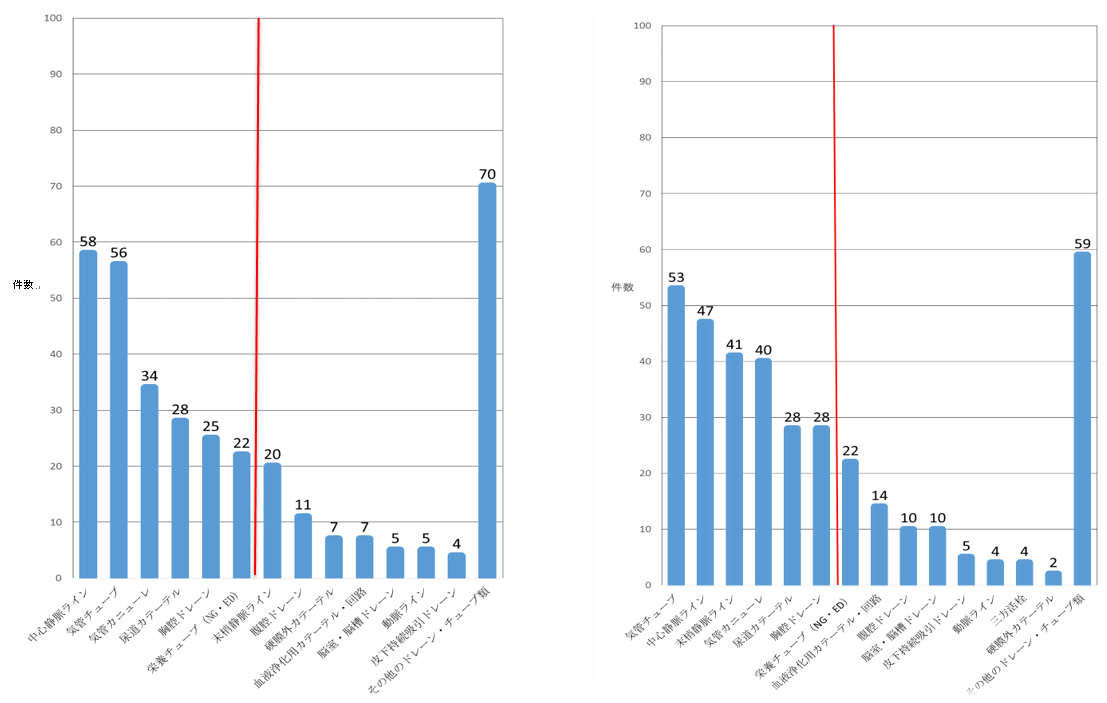
図2 調査対象の各事例において使用されているドレーン・チューブ以外の医療機器の内訳
集計対象期間:平成29年7月1日~平成30年6月30日 集計対象期間:平成30年7月1日~令和元年6月30日
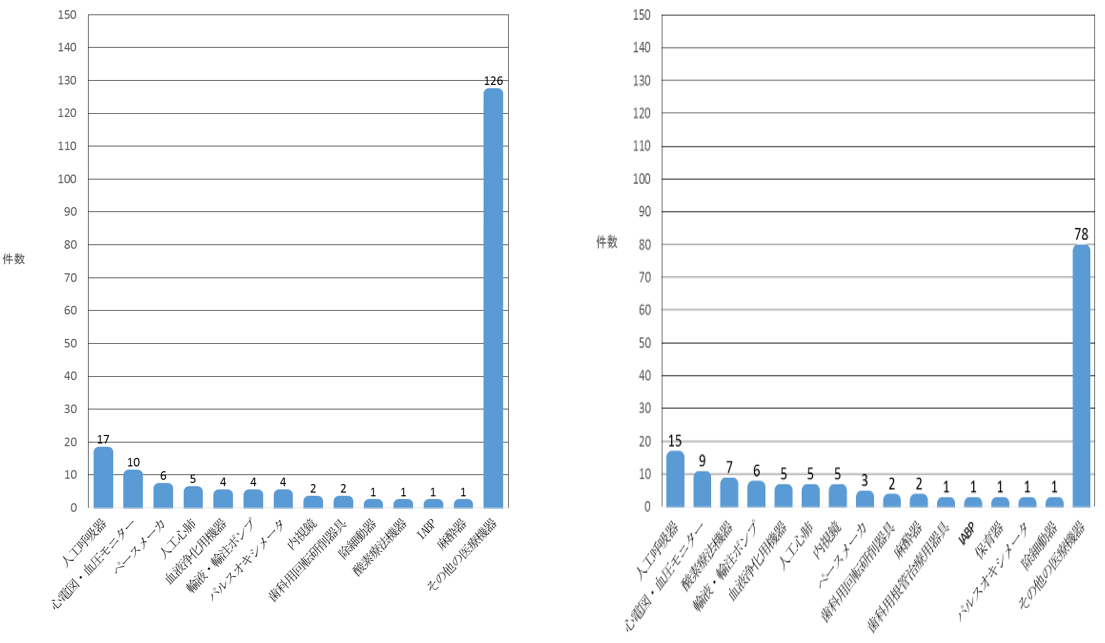
図3 ドレーン・チューブにおける事故の内容の内訳 ※赤線までの製品で全体の約6割を占めている。
集計対象期間:令和元年7月1日~12月31日
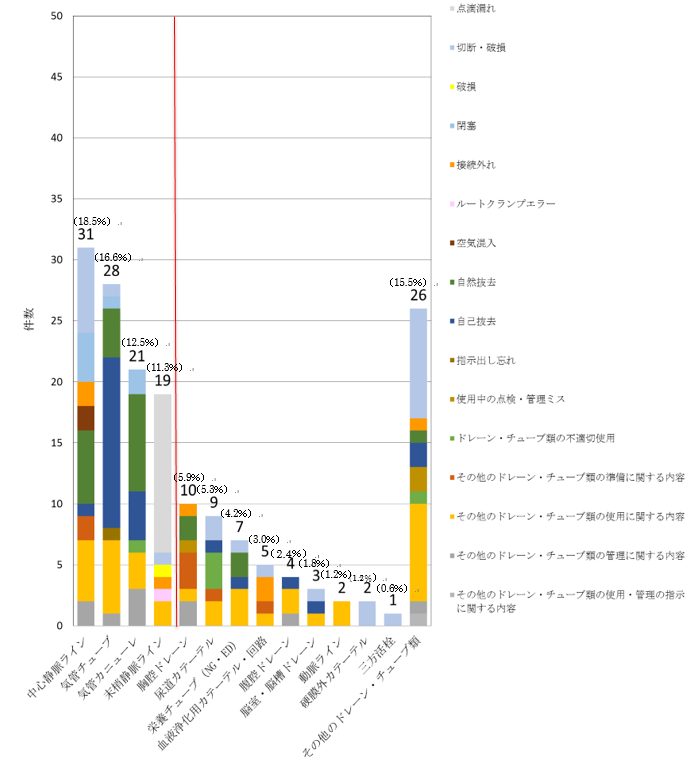
図4 ドレーン・チューブにおける事故の程度の内訳
集計対象期間:令和元年7月1日~12月31日
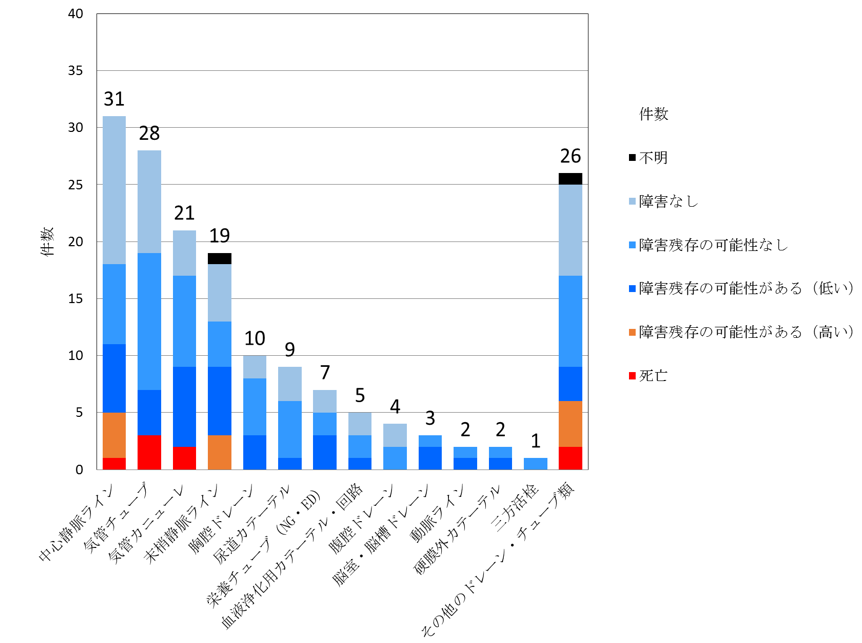
表1 ドレーン・チューブにおけるヒューマンエラー・ヒューマンファクターに起因する事例の事故の程度と内容の内訳(表1)
図5 ドレーン・チューブ以外の医療機器における事故の内容の内訳
集計対象期間:令和元年7月1日~12月31日
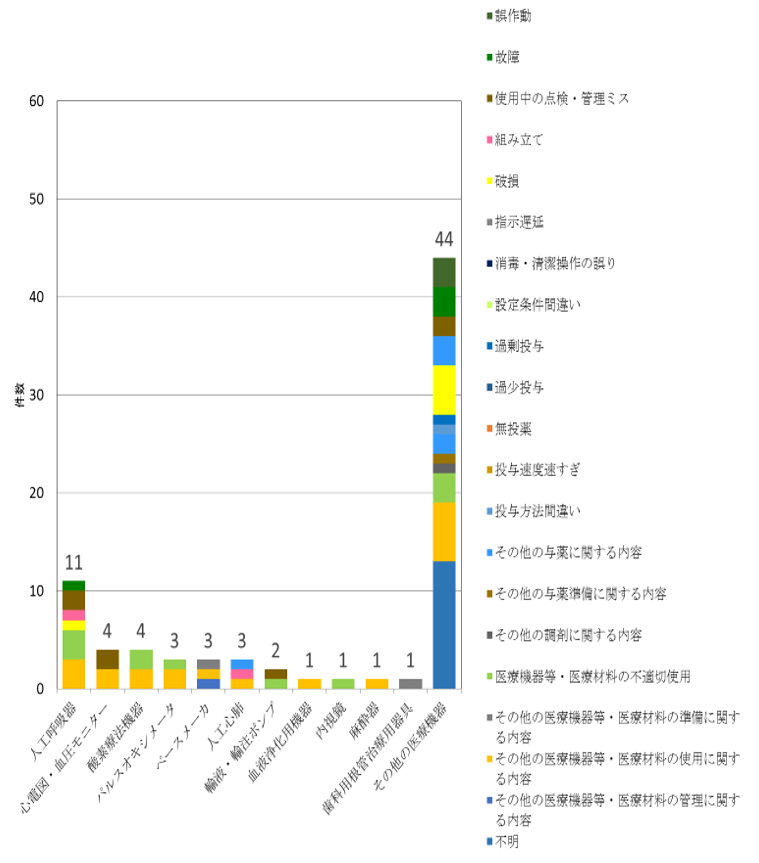
図6 ドレーン・チューブ以外の医療機器における事故の程度の内訳
集計対象期間:令和元年7月1日~12月31日
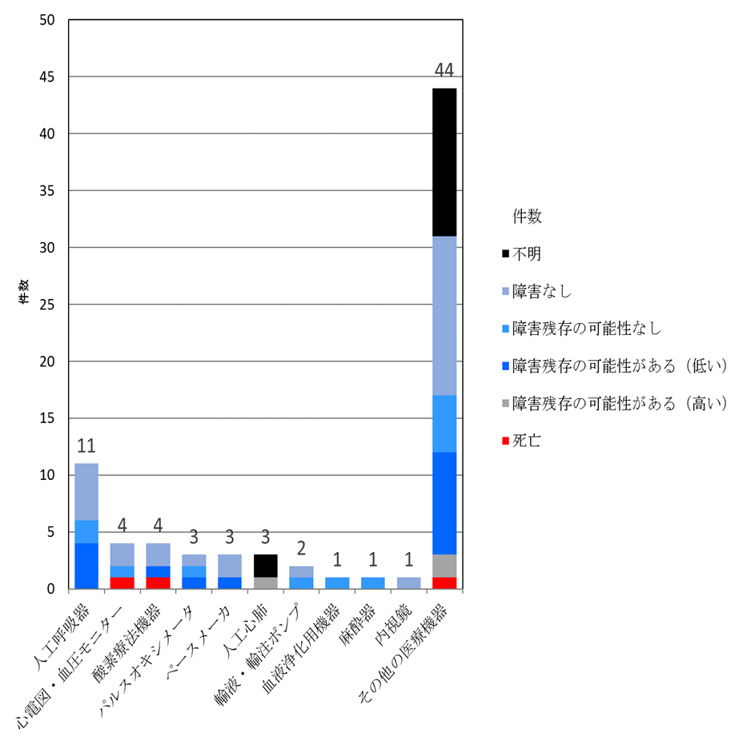
表2 ドレーン・チューブ以外の医療機器におけるヒューマンエラー・ヒューマンファクターに起因する事例の事故の程度と内容の内訳(表2)
- 類似事例数について
調査対象の各事例において、これまでに同様の事例が集積され、PMDA医療安全情報を作成・配信し、注意喚起を実施している事例と同様の事例数をまとめた結果を表3と表4に示す。
| 分類 | 総件数 | 類似事例数 | 内訳 |
|---|---|---|---|
| 気管カニューレ | 21 | 3 |
|
| 中心静脈ライン | 31 | 7 |
|
| 末梢静脈ライン | 19 | 2 |
|
| 気管チューブ | 28 | 2 |
|
| 尿道カテーテル | 9 | 3 |
|
| 胸腔ドレーン | 10 | 0 | |
| 栄養チューブ(NG・ED) | 7 | 3 |
|
| 血液浄化用カテーテル・回路 | 5 | 1 |
|
| 脳室・脳槽ドレーン | 3 | 1 |
|
| 腹腔ドレーン | 4 | 1 |
|
| 動脈ライン | 2 | 0 | |
| 三方活栓 | 1 | 0 | |
| 硬膜外カテーテル | 2 |
1 |
|
| その他のドレーン・チューブ類 | 26 | 3 |
|
| 合計 | 168 | 27 |
| 分類 | 総件数 | 類似事例数 | 内訳 |
|---|---|---|---|
| 人工呼吸器 | 11 | 0 | |
| 酸素療法機器 | 4 | 0 | |
| 心電図・血圧モニター | 4 | 1 |
|
| 内視鏡 | 1 | 1 |
|
| 血液浄化用機器 | 1 | 1 |
|
| 麻酔器 | 1 | 0 | |
| 人工心肺 | 3 | 0 | |
| 輸液・輸注ポンプ | 2 | 1 |
|
| パルスオキシメータ | 3 | 0 | |
| ペースメーカー | 3 | 0 | |
| 歯科用根管治療用器具 | 1 | 0 | |
| その他の医療機器 | 44 | 8 |
|
| 合計 | 78 | 12 |
- 安全使用対策の必要性
医療機器の製造販売業者等による安全使用対策の必要性の有無について、調査対象の全246事例の調査結果を表5に示す。
| 調査結果 | 事例数 | 割合 |
|---|---|---|
| 医療機器の安全使用に関して製造販売業者等による対策が必要又は可能と考えられた事例 | 0 | 0.0% |
| 製造販売業者等により既に対策がとられているもの、もしくは対策を既に検討中の事例 | 12 | 4.9% |
| 製造販売業者等によるモノの対策は困難と考えられた事例 | 234 | 95.1% |
| 計 | 246 | 100% |
4. 調査結果の内訳
- 製造販売業者等により既に対策がとられているもの、もしくは対策を既に検討中の事例(別添1)
- 植込み型除細動器の早期電池消耗の事例(1番)
- 非血管用ガイドワイヤの断裂の事例(2番)
- 輸液ポンプの気泡アラーム機能不全の事例(3番)
- 体外式膜型人工肺の軸位置不良の事例(4番)
- 生検針の動作不良の事例(5番)
- 皮下植込み型ポートのカテーテル断裂の事例(6~11番)
- 三方活栓の破損の事例(12番)
- 製造販売業者によるモノの対策は困難と考えられた事例(ヒューマンエラー、ヒューマンファクター)(別添2)
- 製造販売業者によるモノの対策は困難と考えられた事例(情報不足等)(別添3)
5. その他
令和元年度第3回医療機器・再生医療等製品安全使用対策検討会(令和2年3月開催)において「現在調査中の事例」として報告した「MitraClip NT システム(アボットバスキュラージャパン株式会社)」の「グリッパーライン抜去困難」事例について、以下の通り調査結果を報告する。
当該事例については、薬機法に基づき、不具合報告が提出されている。
調査の結果、当該事象は当該機器の複雑な構造に起因し、製造販売業者から適切な情報提供がなされなかったため未然に防ぐことができず発生したと考えられた。
平成31年4月に関連学会からも「MitraClip使用時の注意喚起について」として使用方法等の注意喚起が行われている。
製造販売業者のとった対策として、適切な情報を提供できるよう担当者に対する社内教育が令和元年10月に行われている。
また、グリッパーラインに係る構造に変更が加えられた次世代製品が令和2年6月に薬事承認され、年内には次世代製品への切り替えが完了する予定である。
これらのことより、現時点での調査結果は「製造販売業者等により既に対策が取られているもの、もしくは対策を既に検討中の事例」に該当するものと考える。
以上
