再生医療等製品患者登録システム
- 再生医療等製品患者登録システムの目的
平成26年11月に施行された医薬品医療機器法では、新たに「再生医療等製品」が定義づけられました。再生医療等製品は、その特性を踏まえた規制として、有効性が推定され、安全性が認められれば、特別に早期に、条件及び期限を付して承認(条件・期限付承認)を受けられる仕組みが構築されました。この仕組みが機能するためには、着実に市販後の情報を収集・評価することが必要です。
再生医療等製品の市販後の安全性等の検証が円滑になされるよう、フォローアップする体制や環境を整備する必要があることから、厚生労働省において「再生医療製品患者登録システムのあり方に関する検討会」が開催され、平成26年6月、再生医療等製品の有効性及び安全情報を収集する患者登録システムについての考え方、あり方について報告書が取りまとめられました。
再生医療等製品患者登録システムの目的は、再生医療等製品の市販後の使用状況や患者予後等のデータを収集し、迅速な安全対策や新たな製品開発等を通して、医療の向上に役立てることです。
<参考情報>
- 再生医療製品患者登録システムの在り方に関する検討会(厚生労働省)
- 再生医療製品患者登録システムの在り方に関する検討会 報告書
- 再生医療等製品患者登録システムへの参加等について(依頼)(平成29年9月28日薬生安発0928第1号)
- 再生医療等製品患者登録システムを利用した研究実施計画書(記載例)
- 再生医療等製品患者登録システムのためのデータベース
再生医療等製品患者登録システムの役割を担うデータベース(以下「DB」という。)は、対象患者・疾患に応じて登録項目を設定する必要があることから、製品あるいは診療領域毎に定義されます。それぞれの製品に応じて、製造販売業者と関係学会等が協力してDBを構築・運用することとしています。
DBの構築形態としては、製品等に応じて、(1)製造販売業者が自らDBを構築・運用する場合、又は(2)関係学会等の既存の患者登録制度を活用する場合のほか、(3)PMDAが平成27年度に公的基盤として構築した患者登録システムのための基本項目データベース(以下「PMDA構築DB」という。)を活用することもできます。
製造販売業者は、承認審査期間中に、患者登録システムとしてのDBの構築・運用をどのような形で行うのかについてPMDAと十分相談、協議を行って市販後の情報収集体制を構築することになります。
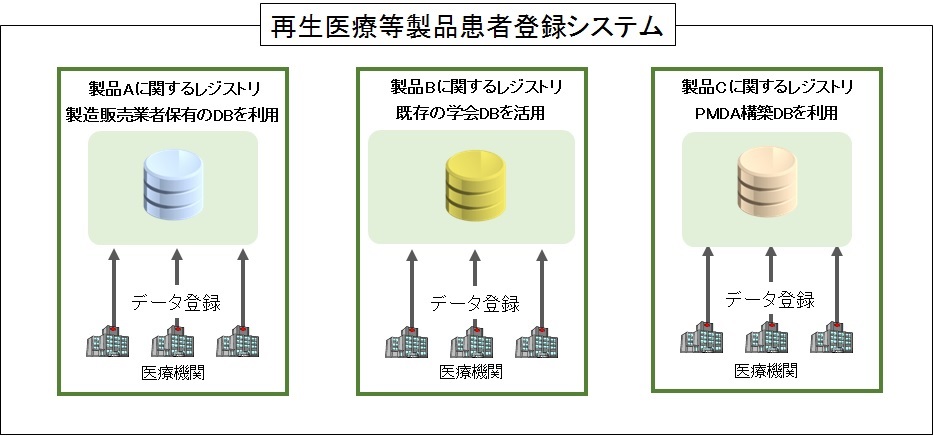
構築形態例
PMDA構築DBでは、将来的な拡張性を考慮し、全再生医療等製品に共通すると考えられる入力項目が設けられています。PMDA構築DBに設けられた入力項目については、以下のリンクより確認できます。
製造販売業者は、各製品における上記入力項目以外の製造販売後調査項目を追加するためのシステム追加構築を行うことにより、PMDA構築DBを活用したデータ収集や再審査申請への利用ができます。
(PMDA構築DB運営主体 連絡先)
一般社団法人日本再生医療学会 サービスデスク
E-mail : support.nrmd@jsrm.jp
- 構築・運用されている再生医療等製品患者登録システム
現在構築されている再生医療等製品患者登録システムのDBについては、以下より確認できます。
再生医療等製品患者登録システムに関する検討会及び分科会
PMDAでは、再生医療等製品患者登録システム全体の運用に関して検討を行うため、関連学会や業界団体から推薦を受けた学識経験者等から成る「再生医療等製品患者登録システムに関する検討会」を平成27年に設置しました。また、検討会の下には、製品あるいは診療領域毎に、必要に応じて分科会を設置することとしています(下図)。検討会及び分科会の役割は以下のとおりであり、現在設置されている分科会は下表のとおりです。
- 検討会:再生医療等製品患者登録システムの運営全体に関する事項、およびPMDA構築DBに関する検討を行う。(検討会委員一覧)
- 分科会:製品あるいは診療領域毎の具体的な運用方針についての検討を行う。
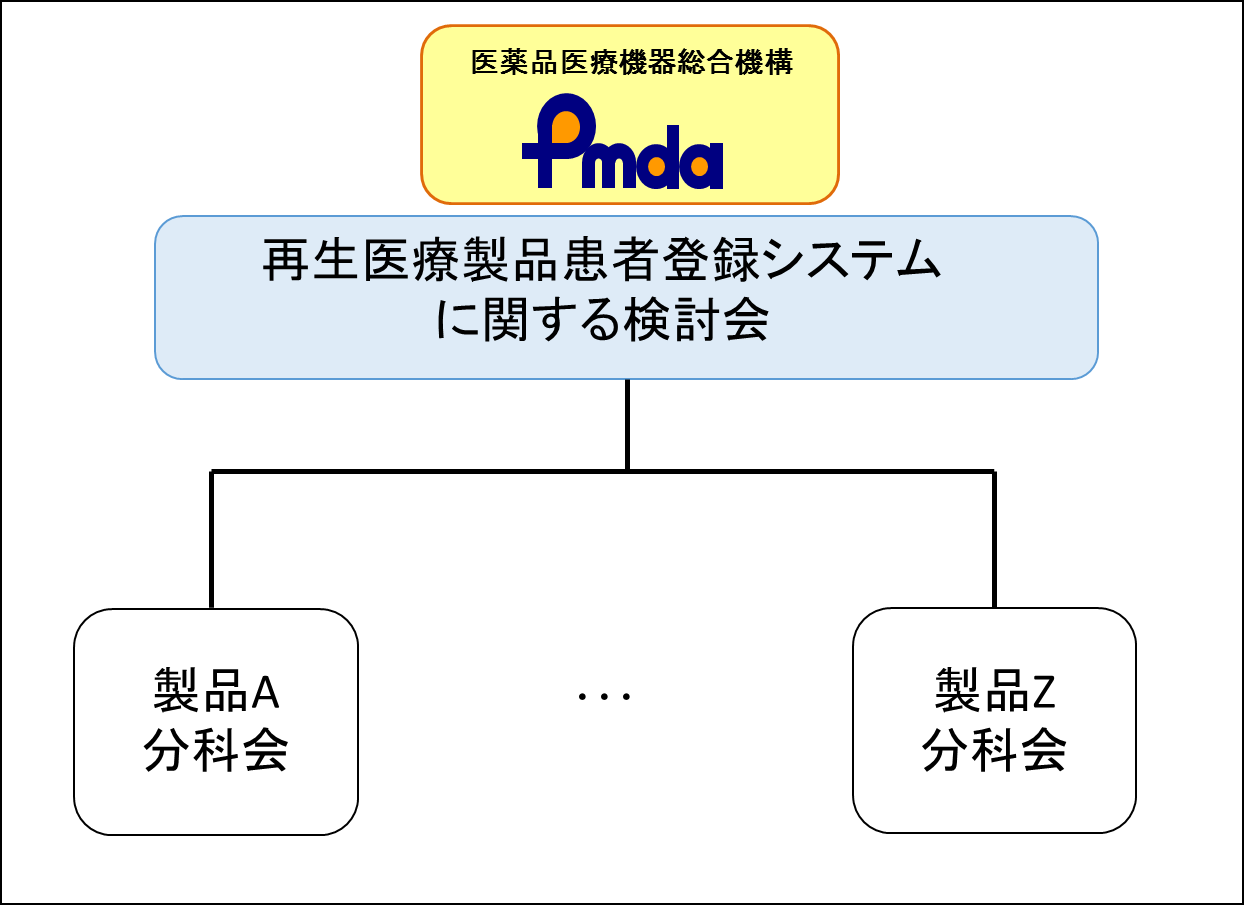
再生医療等製品患者登録システムに関する検討会の組織構造
| 分科会名 | 分科会委員一覧 |
|---|---|
| テムセルHS注分科会 | テムセルHS注分科会委員一覧 |
| ハートシート分科会 | ハートシート分科会委員一覧 |
| ジェイス(母斑)分科会 | ジェイス(母斑)分科会委員一覧 |
| ジェイス(表皮水疱症)分科会 | ジェイス(表皮水疱症)分科会委員一覧 |
再生医療等製品患者登録システムに関する検討会の資料等
「独立行政法人等の保有する情報の公開に関する法律」の趣旨に照らし合わせ、特定の個人を識別することができる情報や個人の権利利益を害するおそれがある情報、法人の権利、競争上の地位その他適当な利益を害するおそれがある情報等について、マスキングを行っております。
| 開催日 | 議事次第・配布資料・議事要旨 |
|---|---|
| 2020年7月3日 | 議事次第・配布資料・議事要旨 |
| 2018年11月28日 | 議事次第・配布資料・議事要旨 |
| 2017年8月10日 | 議事次第・配布資料・議事要旨 |
再生医療等製品患者登録システムの運用方針
製品あるいは診療領域毎に実施される患者登録において、必要な情報が信頼度高く収集できるように運用することを目的に、「再生医療等製品患者登録システムに関する検討会」において、再生医療等製品患者登録システム全体の運用方針を作成しました。さらに分科会において、製品あるいは診療領域毎に構築したシステムについて詳細な運用方針を取り決め、この運用方針に基づき運用されます。
再生医療等製品患者登録システムに関する検討会において作成された運用方針は、以下より確認できます。
連絡先
医薬品医療機器総合機構 医薬品安全対策第二部
TEL:03-3506-9435
