誤接続防止コネクタに係わる国際規格の国内導入
コネクタの誤接続による医療事故事例が国内外で報告されており、これまで経腸栄養ラインと輸液ラインが物理的に接続できないよう基準を改正する等の対応がなされてきました(「医療事故を防止するための医療用具に関する基準の制定等について(注射筒型手動式医薬品注入器基準等)」(2000年8月31日付け医薬発第888号通知))。
近年、ベッドサイドで起こりうるコネクタの誤接続を防止するため、下図の分野において、国際規格の制定が進められてきました。我が国においても、誤接続防止による医療安全の向上や国際整合による製品の安定供給確保の観点から、国際規格の導入が検討されてきました。
数年にわたる検討が続けられた結果、「相互接続防止コネクタに係る国際規格(ISO(IEC)80369シリーズ)の導入について」(2017年10月4日付け日付医政総発1004第1号、薬生薬審発1004第1号、薬生機審発1004第1号、薬生安発1004第1号通知)が発出され、段階的な誤接続防止コネクタの国内導入が決定されました。
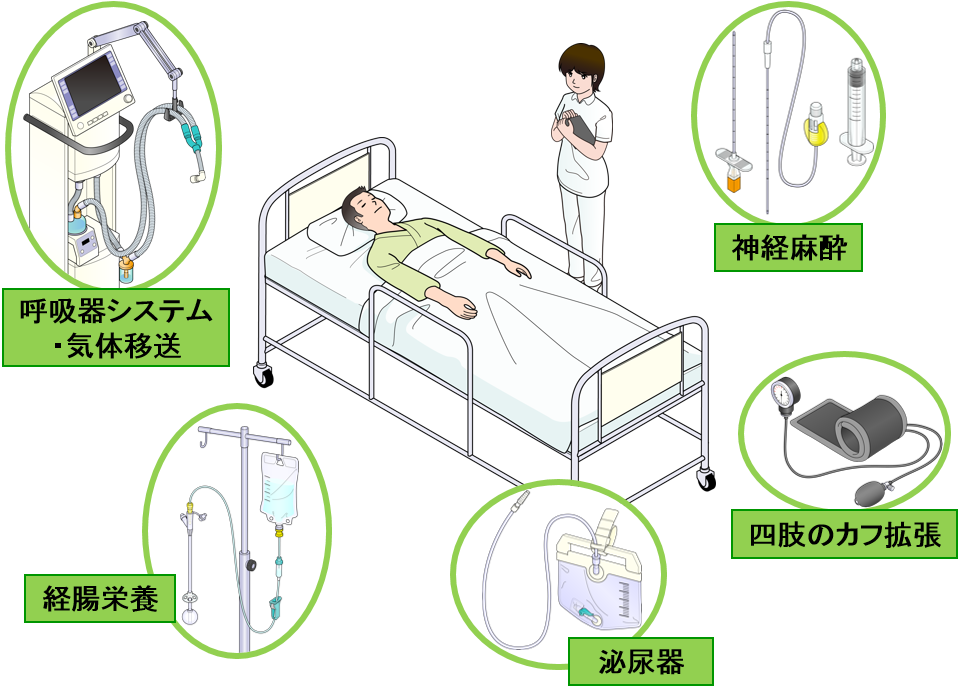
新規格製品の販売開始に伴い、現在市場に流通している規格のコネクタ(旧規格製品)は、販売を終了する予定です(経腸栄養分野の旧規格製品の出荷期限は、医療・介護時の安全性と利便性の両立が可能な新たな製品の開発等がなされるまでの当面の間設けられないこととなっています。詳細は2022年度第1回薬事・食品衛生審議会薬事分科会 医療機器・再生医療等製品安全対策部会安全対策調査会資料をご覧ください。お問合せは厚生労働省医薬・生活衛生局医薬安全対策課安全使用推進室までお願い致します。)。
旧規格製品の販売終了時期は、下記の表を確認ください(掲載情報は順次更新予定)。
| 製品分野 | 旧規格製品 販売終了時期 |
承認基準等 改正時期 |
国際規格制定時期 |
|---|---|---|---|
| 神経麻酔 (例:麻酔用滅菌済み穿刺針 など) |
2020年2月末 | 2018年2月1日 | 2016年3月発行 |
| 経腸栄養 (例:経腸栄養注入セット など) |
未定 | 2018年5月1日 | 2016年7月発行 |
| 四肢のカフ拡張 | - | 2018年2月1日 | 2016年3月発行 |
| 呼吸器システム・気体移送 | 未定 | 未定 | 2024年7月発行 |
| 泌尿器 | 未定 | 未定 | 未定 |
新規格製品の導入に関する注意事項
今後、新規格に基づく製品が順次上市される見込みですが、製品分野によっては新規格製品と旧規格製品との間で、非嵌合となるため、各医療機関における医療安全に関する管理上の影響が懸念されます。混乱することなく新規格製品を導入するためには、適切な在庫管理と施設内関係者への情報共有が重要です。
そのため、各医療機関での新規格製品の購入・切替えに際しては、下記の点を参考に医療機関内での対応等について、ご検討をお願いします。
- 情報一元化のため、販売業者等との調整を行う担当部署と責任者(医療機器安全管理責任者等)を決定してください。
- 製品の切替えを漏れなく確実に行えるよう、分野ごとに対象となる製品リストを作成し、変換コネクタの取扱いを確認してください。
- 販売業者等に切替え開始時期・供給終了時期等の確認をし、施設内の切替え方法やスケジュールを検討してください。
- 販売業者または担当部署(責任者)が説明会などを行い、施設内関係者に周知してください。
- 接続不可能な製品の混在を防止するための製品保管方法を検討してください。
また、新規格製品の医療機関への導入に向けて、医療現場での旧規格製品から新規格製品への切替え業務に活用いただけるチェックリストの例を公開しています。チェックリスト(例)については、複数の診療科での切替えが発生する場合を想定して、作成しており、手順等が多く記載されております。不要な手順等については、必要に応じて、修正等していただいた上で、切替え業務に活用ください。
| 製品分野 | 関連資材 |
|---|---|
| 神経麻酔 |
|
| 経腸栄養 |
|
(注) イラストの転載はご遠慮ください。
<経腸栄養分野以外の変換コネクタについて>
新規格製品と旧規格製品を接続するためのコネクタ(変換コネクタ)は、原則として使用できません。
ただし、医療現場において、旧規格製品と新規格製品が相互で非嵌合となることにより治療等に支障をきたすリスクを回避するために医療機関から要請があった場合に限り、製造販売業者より必要最小限量の変換コネクタが提供されます。変換コネクタが必要な場合には、該当製品の製造販売業者までお問い合わせください。
業界団体・関係学会からのお知らせ及び問い合せ先
各分野において切替えが必要な製品の一般的名称は、下記のPDFより確認してください。また、規格が変更される製品は多岐にわたるため、新規格製品の導入時期や現在購入している製品の規格が変更されるどうか、変換コネクタ供給の有無等の問い合わせは、下記の関連情報掲載ページに掲載されている対象製品リストを参考に、各製品を取り扱っている製造販売業者あるいは販売業者に直接問い合わせてください。なお、各製品分野の最新情報については、関係学会のホームページを確認してください。
| 製品分野 | 一般的名称一覧(注) | 業界団体 | 関係学会 |
|---|---|---|---|
| 神経麻酔 | 神経麻酔分野(ISO 80369-6)の対象品目一覧 | 一般社団法人 医療機器テクノロジー協会(MTJAPAN) | 公益社団法人 日本麻酔科学会 |
| 経腸栄養 | 経腸栄養分野(ISO 80369-3)の対象品目一覧 | MTJAPAN, 一般社団法人日本流動食協会 |
一般社団法人 日本臨床栄養代謝学会 |
(注)関連通知より抜粋
国際規格や規格が変更される製品分野の詳細など、個別の製品によらない問い合わせについては、MTJAPANにおいて問い合わせを受けていますので、上記リンクよりHPをご確認ください。
厚生労働省からの関連情報
関連する通知等を掲載しています。
| 発出年月日 | 表題 |
|---|---|
| 2023年10月10日 事務連絡 |
経腸栄養分野の小口径コネクタ製品の切替えに係る方針の一部見直し及び旧規格に適合した経腸栄養分野の小口径コネクタ製品を製造販売する場合の取扱いに関するQ&Aについて [91 KB] |
| 2022年6月30日 薬生薬審発0630第2号 薬生機審発0630第1号 薬生安発0630第1号 |
旧規格に適合した経腸栄養分野の小口径コネクタ製品を製造販売する場合の取扱いについて [99 KB] |
| 2022年5月20日 医政安発0520第1号 薬生薬審発0520第7号 薬生機審発0520第1号 薬生安発0520第1号 |
経腸栄養分野の小口径コネクタ製品の切替えに係る方針の一部見直しについて [351 KB] |
| 2021年2月16日 医政安発0216第5号 薬生薬審発0216第1号 薬生機審発0216第1号 薬生安発0216第1号 |
経腸栄養分野の小口径コネクタ製品に係る旧規格製品の出荷期間の延長について [144 KB] |
| 2018年3月16日 医政安発0316第1号 薬生薬審発0316第1号 薬生機審発0316第1号 薬生安発0316第1号 |
経腸栄養分野の小口径コネクタ製品の切り替えについて [230 KB] |
| 2017年12月27日 医政総発1227第1号 薬生薬審発1227第1号 薬生機審発1227第1号 薬生安発1227第1号 |
神経麻酔分野の小口径コネクタ製品の切替えについて [646 KB] |
| 2017年10月4日 医政総発1004第1号 薬生薬審発1004第1号 薬生機審発1004第1号 薬生安発1004第1号 |
相互接続防止コネクタに係る国際規格(ISO(IEC)80369シリーズ)の導入について [879 KB] |
本件に係る会議等の資料を掲載しています。
| 開催日 | 表題 |
|---|---|
| 2022年5月10日 | 2022年度第1回薬事・食品衛生審議会薬事分科会 医療機器・再生医療等製品安全対策部会安全対策調査会資料 |
| 2021年1月22日 | 2020年度第1回薬事・食品衛生審議会薬事分科会 医療機器・再生医療等製品安全対策部会安全対策調査会資料 |
| 2015年5月12日 | 第27回 医薬品・医療機器等対策部会 |
PMDAからの関連情報
関連するPMDA医療安全情報を掲載しています。
| No. | 発行年月日 | 表題 |
|---|---|---|
| 58 | 2022年5月 (改訂) 2019年7月 |
誤接続防止コネクタの導入について(経腸栄養分野)[874.22 KB] |
| 55 | 2018年8月 | 誤接続防止コネクタの導入について(神経麻酔分野)[1.48 MB] |
| 53 | 2018年3月 | 誤接続防止コネクタの導入について [726.30 KB] |
誤接続防止コネクタに関する講演資料等を掲載しています。
連絡先
本ページに関する問い合わせはこちらにお願いします。
医薬品医療機器総合機構 医療機器安全対策・基準部 医療安全情報管理課
電話番号: 03-3506-9486
