目次
(参考資料)
インフルエンザ治療に携わる医療関係者の皆様へ
(インフルエンザ治療開始後の注意事項についてのお願い)
この医薬品・医療機器等安全性情報は, 厚生労働省において収集された副作用等の情報をもとに, 医薬品・医療機器等のより安全な使用に役立てていただくために, 医療関係者に対して情報提供されるものです。
平成19年(2007年)3月
厚生労働省医薬食品局
| No. | 医薬品等 | 対策 | 情報の概要 |
|---|---|---|---|
| 1 | 注射針等カラーコードの統一について | 厚生労働省では, 滅菌済み注射針, 末梢血管用滅菌済み留置針, 気道用吸引カテーテル等及びカテーテルの外径に係るカラーコードを平成19年4月1日より統一されたカラーコード製品へ移行することから, これまでの経緯, 変更の概要, 移行期間について紹介する。 | |
| 2 | 潤腸湯他(2件) | (使) (症) |
平成19年2月16日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容等とともに改訂の根拠となった症例の概要等に関する情報を紹介する。 |
| 3 | 塩酸ドネペジル他(9件) | 使用上の注意の改訂について(その185) | |
| 4 | 市販直後調査対象品目 | 平成19年3月1日現在, 市販直後調査の対象品目一覧を紹介する。 |
(緊):緊急安全性情報の配布 (使):使用上の注意の改訂 (症):症例の紹介
|
厚生労働大臣への副作用等報告は, 医療関係者の業務です。 医師, 歯科医師, 薬剤師等の医療関係者は, 医薬品や医療機器による副作用, 感染症, 不具合を知ったときは, 直接又は当該医薬品等の製造販売業者を通じて厚生労働大臣へ報告してください。なお, 薬種商販売業や配置販売業の従事者も医療関係者として, 副作用等につき, 報告することが求められています。 |
注射針等カラーコードの統一について
1.はじめに
厚生労働省では, 滅菌済み注射針, 末梢血管用滅菌済み留置針, 気道用吸引カテーテル等(以下, 「注射針等」という。)及びカテーテルの外径に係るカラーコードの統一化を図るため, 平成17年3月25日付厚生労働省告示第112号「厚生労働大臣が基準を定めて指定する医療機器」(以下, 「本告示」という。)を示しているところである。
本告示のうち, 注射針等に係る部分が平成19年4月1日より施行され, 統一されたカラーコード製品へ移行することから, これまでの経緯, 変更の概要, 移行期間について周知を図り, 医療関係者へ注意喚起するものである。
2.経緯
注射針等については, 薬事法第23条の2第1項に基づき, 厚生労働大臣が定めた基準に適合するものには認証が与えられ, 製造販売することができることとされている。注射針等及びカテーテルの外径を示すカラーコードについて, 国内ではこれまで統一された規格がなかった。そのため, 製造販売業者がそれぞれ独自に色を決め, 同一規格の製品でも製造販売業者によっては色が異なることがあり, 安全上必ずしも好ましい状態ではなかった。
このため, 本告示により, 性能, 品質, 使用目的等について, 注射針等の基準を定めた。これらの基準のうち, 色に関する基準も含む品質に係る部分は日本工業規格(JIS)を活用することとし, その内容は国際的な規格であるISO規格との整合にも配慮を行った。これらの基準に適合し, 新しいカラーコードにより着色された製品は, 国内の流通事情等に鑑み, 平成19年4月1日以降出荷される製品に適用される。
3.変更の概要
(1)対象とする注射針等について
- 注射針(単回使用皮下注射用針, 単回使用動脈注射用針, 単回使用注射用針, 汎用針付注射筒)
- 採血用針(単回使用採血用針)
- 翼付針(単回使用一般静脈用翼付針, 単回使用頭皮静脈用翼付針)
- 血液透析用留置針(単回使用透析用針, 血液透析用シングルニードル付カテーテル, 透析用留置針)
- 末梢血管用留置針(プラスチックカニューレ型滅菌済み穿刺針)
- 気道用吸引カテーテル(吸引キット, 気管支吸引用カテーテル, 吸引用滅菌済みチューブ及びカテーテル, 気管吸引カテーテル)
なお, 上記を含んだ製品(例えば, 輸液セット, 輸血セットなど)も変更の対象となる。
- 輸液セット(輸液ポンプ用輸液セット, 自然落下式・ポンプ接続兼用輸液セット)
- 輸血セット(交換輸血用輸血セット, 輸血セット)
(2)統一するカラーコードについて
本告示による注射針等の基準によるカラーコードは, 以下のとおりである。これらは, 相当する日本工業規格(JIS)又はJISにおいて準用するISO規格に従ったものである。
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * | 輸液セット, 輸血セットなどについては, それぞれの日本工業規格(JIS)の中に注射針等のJISが引用されていることから, 注射針等についての変更に併せて変更することとされた。 |
| * | カラーコードの色表記は日本工業規格(JIS)又はISO規格に基づいた記載としている。 |
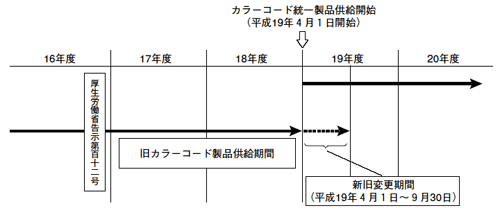
(3)統一カラーコードへの移行期間について
本告示のうち注射針等に係る基準が平成19年4月1日に施行されることから, これらの製品の製造販売業者は, 平成19年4月1日から統一されたカラーコード製品の供給を開始し, 移行期間の終了する同年9月30日までの半年間において基準に適合した製品に切換えることとなる。平成19年10月1日以降は, 統一カラーコード製品以外の色を用いた注射針等は製造販売できないとされているが, 平成19年4月1日から同年9月30日までの間は, 新旧製品が混在することとなる。
移行期間について
4.医療関係者へのお願い
今後, 医療機関において注射針等を使用する際は, 針及びカテーテルの外径とカラーコードについて取り間違いを起こさないよう, 一層の注意をお願いしたい。特に, 日常的にサイズの識別をカラーコードで呼称している場合(例えば, 19ゲージの注射針を「茶色針」と呼んでいる場合等)は, 必ず○○ゲージ又は○○フレンチ等と, サイズの確認方法を具体的なサイズでの呼称に変更することも必要となる。各医療機関においては, 注射針等カラーコードの統一について十分ご理解いただき, 取り扱いにあたっては注意確認の徹底をお願いしたい。
5.おわりに
カラーコード等の情報入手方法については, 日本医療器材工業会ホームページ(http://www.jmed.jp/)において, カラーコード等の情報が掲載されている。また, 変更に関する詳細情報は, 各医療機関が使用している注射針等の製造販売業者にお問合せいただきたい。
なお, 同様の情報は, 医薬品医療機器総合機構の医薬品医療機器情報提供ホームページ(https://www.pmda.go.jp/)の「医療安全情報」に掲載されている。
重要な副作用等に関する情報
平成19年2月16日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容等とともに改訂の根拠となった症例の概要等に関する情報を紹介いたします。
【1】潤腸湯
| 販売名(会社名) | ツムラ潤腸湯エキス顆粒(医療用)(ツムラ) 太虎堂の潤腸湯エキス顆粒(太虎精堂製薬) |
| 薬効分類等 | 漢方製剤 |
| 効能効果 | 便秘 |
| 《使用上の注意(下線部追加改訂部分)》 | |
| [副作用 (重大な副作用)] |
間質性肺炎:発熱, 咳嗽, 呼吸困難, 肺音の異常(捻髪音)等があらわれた場合には, 本剤の投与を中止し, 速やかに胸部X線等の検査を実施するとともに副腎皮質ホルモン剤の投与等の適切な処置を行うこと。また, 発熱, 咳嗽, 呼吸困難等があらわれた場合には, 本剤の服用を中止し, ただちに連絡するよう患者に対し注意を行うこと。 |
| 〈参 考〉 | 直近約3年間(平成15年4月~平成18年12月)の副作用報告(因果関係が否定できないもの)の件数 ・間質性肺炎:2例(うち死亡0例) 関係企業が推計したおおよその年間使用者数:約2万1000人(平成17年度) 販売開始:昭和61年 |
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 女 70代 |
便秘症 (なし) |
7.5g 約3ヵ月間 |
間質性肺炎
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
臨床検査値
血液ガス
BALF所見
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 併用薬:酪酸菌製剤, 酸化マグネシウム, センノシド, ジソピラミド, 塩酸ベラパミル, アズレンスルホン酸ナトリウム・L-グルタミン, ユビデカレノン, クエン酸タンドスピロン | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
【2】清肺湯
| 販売名(会社名) | ツムラ清肺湯エキス顆粒(医療用)(ツムラ) |
| 薬効分類等 | 漢方製剤 |
| 効能効果 | 痰の多く出る咳 |
| 《使用上の注意(下線部追加改訂部分)》 | |
| [副作用 (重大な副作用)] |
肝機能障害, 黄疸:AST(GOT), ALT(GPT), Al-P, γ-GTP等の著しい上昇を伴う肝機能障害, 黄疸があらわれることがあるので, 観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 |
| 〈参 考〉 | 直近約3年間(平成15年4月~平成19年1月)の副作用報告(因果関係が否定できないもの)の件数 ・肝機能障害, 黄疸:2例(うち死亡0例) 関係企業が推計したおおよその年間使用者数:約2万4000人(平成17年度) 販売開始:昭和61年 |
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 女 60代 |
慢性気管支炎 (胆石症, 高脂血症) |
9.0g 69日間 |
肝機能障害
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
臨床検査値
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 併用薬:テオフィリン, フドステイン, クラリスロマイシン, フマル酸ケトチフェン, プラバスタチンナトリウム | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
【3】ランソプラゾール, ランソプラゾール・アモキシシリン・クラリスロマイシン
(1)ランソプラゾール
| 販売名(会社名) | スタンゾームカプセル15, 同カプセル30(シオノケミカル) タイプロトンカプセル15mg, 同カプセル30mg(大正薬品工業) タケプロンカプセル15, 同カプセル30, 同OD錠15, 同OD錠30, 同静注用30mg(武田薬品工業) タピゾールカプセル15, 同カプセル30(大洋薬品工業) ラソプランカプセル15mg, 同カプセル30mg(沢井製薬) ラプラゾールカプセル15mg, 同カプセル30mg(東和薬品) ランソプラゾールカプセル15mg「MED」, 同カプセル30mg「MED」(メディサ新薬) ランソプラゾールカプセル15mg「アメル」, 同カプセル30mg「アメル」(共和薬品工業) ランソラールカプセル15, 同カプセル30(日医工) |
| 薬効分類等 | 消化性潰瘍用剤 |
| 効能効果 | (内服) 胃潰瘍, 十二指腸潰瘍, 吻合部潰瘍, 逆流性食道炎, Zollinger-Ellison症候群, 非びらん性胃食道逆流症(タケプロンカプセル15mg, 同OD錠15のみ), 胃潰瘍又は十二指腸潰瘍におけるヘリコバクター・ピロリの除菌の補助(タケプロンカプセル15, 同カプセル30, 同OD錠15, 同OD錠30のみ) (注射) 経口投与不可能な下記の疾患 出血を伴う胃潰瘍, 十二指腸潰瘍, 急性ストレス潰瘍及び急性胃粘膜病変 |
(2)ランソプラゾール・アモキシシリン・クラリスロマイシン
| 販売名(会社名) | ランサップ400, 同800(武田薬品工業) |
| 薬効分類等 | その他の抗生物質製剤 |
| 効能効果 | <適応菌種> アモキシシリン, クラリスロマイシンに感性のヘリコバクター・ピロリ <適応症> 胃潰瘍・十二指腸潰瘍におけるヘリコバクター・ピロリ感染症 |
| 《使用上の注意(下線部追加改訂部分)》 | |||
| [副作用 (重大な副作用)] |
間質性腎炎があらわれ, 急性腎不全に至ることもあるので, 腎機能検査値(BUN, クレアチニン上昇等)に注意し, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 | ||
| 〈参 考〉 | (1)(2)について, 直近約3年間(平成15年4月~平成18年12月)の副作用報告(因果関係が否定できないもの)の件数 ・間質性腎炎:5例(うち死亡0例) 関係企業が推計したおおよその年間使用者数:約650万人(平成18年)
|
||
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | ||||||||||||||||||||||||||||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | |||||||||||||||||||||||||||||||||||||||||||
| 1 | 男 70代 |
胃癌による癌性潰瘍からの出血 (糖尿病, 胃癌) |
30mg 8日間 |
急性腎不全 既往歴:なし
|
|||||||||||||||||||||||||||||||||||||||||
臨床検査値
|
|||||||||||||||||||||||||||||||||||||||||||||
| 併用薬:塩酸ピオグリタゾン, グリメピリド, ブロチゾラム | |||||||||||||||||||||||||||||||||||||||||||||
| No. | 患者 | 1日投与量 投与期間 |
副作用 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 性 ・ 年齢 |
使用理由 (合併症) |
経過及び処置 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 男 60代 |
胃潰瘍[A2 stage] (高血圧症, Bell麻痺) |
30mg 20日間 |
尿細管間質性腎炎 既往歴:薬剤による皮疹, 虫垂炎
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
臨床検査値
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 併用薬:なし | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
使用上の注意の改訂について(その185)
平成19年2月16日に改訂を指導した医薬品の使用上の注意(本号の「2重要な副作用等に関する情報」で紹介したものを除く。)について, 改訂内容, 主な該当販売名等をお知らせいたします。
| 1 | 〈その他の中枢神経系用薬〉 塩酸ドネペジル |
|
| [販売名] | アリセプト細粒0.5%, 同錠3mg, 同錠5mg, 同D錠3mg, 同D錠5mg(エーザイ) |
| [重要な基本 的注意] |
本剤の投与により, 徐脈, 心ブロック(洞房ブロック, 房室ブロック), QT延長等があらわれることがあるので, 特に心疾患(心筋梗塞, 弁膜症, 心筋症等)を有する患者や電解質異常(低カリウム血症等)のある患者等では, 重篤な不整脈に移行しないよう観察を十分に行うこと。 |
| [副作用 (重大な副作用)] |
失神, 徐脈, 心ブロック, QT延長, 心筋梗塞, 心不全:失神, 徐脈, 心ブロック(洞房ブロック, 房室ブロック), QT延長, 心筋梗塞, 心不全があらわれることがあるので, このような症状があらわれた場合には, 投与を中止するなど適切な処置を行うこと。 |
| 2 | 〈鎮けい剤〉 バクロフェン(経口剤) |
|
| [販売名] | ギャバロン錠5mg, 同錠10mg(第一製薬), リオレサール錠5mg, 同錠10mg(ノバルティスファーマ) |
| [用法・用量に関連 する使用上の注意] |
本剤は大部分が未変化体のまま尿中に排泄されるため, 腎機能が低下している患者では血中濃度が上昇することがあるので, このような患者では低用量から投与を開始すること。特に透析を必要とするような重篤な腎機能障害を有する患者においては, 1日5mgから投与を開始するなど慎重に投与すること。 |
| [慎重投与] | 腎機能低下のある患者〔本剤は大部分が未変化体のまま尿中に排泄されるため, このような患者では血中濃度が上昇することがあるので, 用量の調節に注意すること。特に透析を必要とするような重篤な腎機能障害を有する患者においては, 過量投与の症状(意識障害, 呼吸抑制等)に注意すること。〕 |
| [副作用 (重大な副作用)] |
意識障害, 呼吸抑制:意識障害, 呼吸抑制等の中枢神経抑制症状があらわれることがあるので, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。特に腎機能障害を有する患者においてあらわれやすいので注意すること。 |
| 3 | 〈止血剤〉 ポリドカノール(食道静脈瘤硬化剤) |
|
| [販売名] | エトキシスクレロール1%注射液(堺化学工業) | |
| [禁 忌] |
|
|
| [副作用 (重大な副作用)] |
ショック, アナフィラキシー様症状:ショック, アナフィラキシー様症状があらわれることがあるので, 投与時から患者の状態を十分に観察するとともに, 喘鳴, 呼吸困難, 血圧低下, 意識消失, 全身潮紅, 蕁麻疹, 血管浮腫(顔面浮腫, 喉頭浮腫等)等があらわれた場合には投与を中止し, 適切な処置を行うこと。 |
| 4 | 〈その他の腫瘍用薬〉 塩酸ファドロゾール水和物 |
|
| [販売名] | アフェマ錠1mg(ノバルティスファーマ) |
| [重要な基本 的注意] |
本剤の投与によって, 骨粗鬆症, 骨折が起こりやすくなるので, 骨密度等の骨状態を定期的に観察することが望ましい。 |
| 5 | 〈その他の腫瘍用薬〉 レトロゾール |
|
| [販売名] | フェマーラ錠2.5mg(ノバルティスファーマ) |
| [重要な基本的注意] | 本剤の投与によって, 骨粗鬆症, 骨折が起こりやすくなるので, 骨密度等の骨状態を定期的に観察することが望ましい。 |
| 6 | 〈抗ウイルス剤〉 リバビリン |
|
| [販売名] | レベトールカプセル200mg(シェリング・プラウ) |
| [副作用 (重大な副作用)] |
消化管出血(下血, 血便等), 消化性潰瘍, 小腸潰瘍, 虚血性大腸炎:観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 溶血性尿毒症症候群(HUS), 血栓性血小板減少性紫斑病(TTP):血小板減少, 貧血, 腎不全を主徴とする溶血性尿毒症症候群(HUS), 血栓性血小板減少性紫斑病(TTP)があらわれることがあるので, 定期的に血液検査(血小板数, 赤血球数等)及び腎機能検査を行うなど観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 |
| 7 | 〈その他の生物学的製剤〉 インターフェロンアルファ-2b(遺伝子組換え) |
|
| [販売名] | イントロンA注射用300, 同注射用600, 同注射用1,000(シェリング・プラウ) |
| [副作用 (重大な副作用)] |
溶血性尿毒症症候群(HUS), 血栓性血小板減少性紫斑病(TTP):血小板減少, 貧血, 腎不全を主徴とする溶血性尿毒症症候群(HUS), 血栓性血小板減少性紫斑病(TTP)があらわれることがあるので, 定期的に血液検査(血小板数, 赤血球数等)及び腎機能検査を行うなど観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 |
| 8 | 〈その他の生物学的製剤〉 ペグインターフェロンアルファ-2b(遺伝子組換え) |
|
| [販売名] | ペグイントロン皮下注用50μg/0.5mL用, 同皮下注用100μg/0.5mL用, 同皮下注用150μg/0.5mL用(シェリング・プラウ) |
| [副作用 (重大な副作用)] |
血栓性血小板減少性紫斑病(TTP):血小板減少, 貧血, 腎不全を主徴とする血栓性血小板減少性紫斑病(TTP)があらわれることがあるので, 定期的に血液検査(血小板数, 赤血球数等)を行うなど観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 |
| 9 | 一般用医薬品 潤腸湯 |
|
| [販売名] | 潤腸湯エキス顆粒KM(カーヤ), 漢方便秘薬潤腸湯(大虎精堂製薬)他 | |||||||||
| [相談すること] | 次の場合は, 直ちに服用を中止し, この文書を持って医師又は薬剤師に相談すること
|
|||||||||
| 10 | 一般用医薬品 清肺湯 |
|
| [販売名] | 松鶴天与(エキス顆粒)(建林松鶴堂), トチモトの清肺湯(栃本天海堂)他 | |||||||||
| [相談すること] | 次の場合は, 直ちに服用を中止し, この文書を持って医師又は薬剤師に相談すること
|
|||||||||
市販直後調査の対象品目一覧
| (平成19年3月1日現在) |
| 一般名 | 製造販売業者名 | 市販直後調査開始年月日 |
| 販売名 | ||
| アレンドロン酸ナトリウム水和物 | 萬有製薬(株) | 平成18年9月15日 |
| フォサマック錠35mg | ||
| アレンドロン酸ナトリウム水和物 | 帝人ファーマ(株) | 平成18年9月15日 |
| ボナロン錠35mg | ||
| イトラコナゾール | ヤンセンファーマ(株) | 平成18年9月15日 |
| イトリゾール内用液1% | ||
| テモゾロミド | シェリング・プラウ(株) | 平成18年9月15日 |
| テモダールカプセル20mg, 同カプセル100mg | ||
| ブデソニド | アストラゼネカ(株) | 平成18年9月15日 |
| パルミコート吸入液0.25mg, 同吸入液0.5mg | ||
| エンテカビル水和物 | ブリストル・マイヤーズ(株) | 平成18年9月21日 |
| バラクルード錠0.5mg | ||
| 酢酸セトロレリクス | 日本化薬(株) | 平成18年9月21日 |
| セトロタイド注射用0.25mg, 同注射用3mg | ||
| 塩化マンガン四水和物 | 明治乳業(株) | 平成18年9月25日 |
| ボースデル内用液10 | ||
| ガバペンチン | ファイザー(株) | 平成18年9月25日 |
| ガバペン錠200mg, 同錠300mg, 同錠400mg | ||
| 塩酸オロパタジン | 日本アルコン(株) | 平成18年10月5日 |
| パタノール点眼液0.1% | ||
| ブスルファン | 麒麟麦酒(株) | 平成18年10月10日*1 |
| ブスルフェクス点滴静注用60mg | 平成18年10月20日*2 | |
| 塩酸フェキソフェナジン | サノフィ・アベンティス(株) | 平成18年10月20日 |
| アレグラ錠60mg*3 | ||
| 塩酸ランジオロール | 小野薬品工業(株) | 平成18年10月20日 |
| 注射用オノアクト50*4 | ||
| モザバプタン塩酸塩 | 大塚製薬(株) | 平成18年10月24日 |
| フィズリン錠30mg | ||
| インターフェロンベータ-1a(遺伝子組換え) | バイオジェン・アイデック・ジャパン(株) | 平成18年11月6日 |
| アボネックス筋注用シリンジ30μg | ||
| 塩酸モキシフロキサシン | 日本アルコン(株) | 平成18年11月6日 |
| ベガモックス点眼液0.5% | ||
| 肺炎球菌ワクチン | 萬有製薬(株) | 平成18年11月29日 |
| ニューモバックスNP | ||
| ボルテゾミブ | ヤンセンファーマ(株) | 平成18年12月1日 |
| ベルケイド注射用3mg | ||
| イトラコナゾール | ヤンセンファーマ(株) | 平成18年12月6日 |
| イトリゾール注1% | ||
| ロピニロール塩酸塩 | グラクソ・スミスクライン(株) | 平成18年12月6日 |
| レキップ錠0.25mg, 同錠1mg, 同錠2mg | ||
| ランソプラゾール | 武田薬品工業(株) | 平成18年12月7日 |
| タケプロン静注用30mg | ||
| ロサルタンカリウム・ヒドロクロロチアジド | 萬有製薬(株) | 平成18年12月8日 |
| プレミネント錠 | ||
| ポリドカノール | 堺化学工業(株) | 平成18年12月14日 |
| ポリドカスクレロール0.5%注2mL, 同1%注2mL, 同3%注2mL | ||
| 塩酸フェキソフェナジン | サノフィ・アベンティス(株) | 平成19年1月9日 |
| アレグラ錠30mg | ||
| ペルフルブタン | 第一製薬(株) | 平成19年1月10日 |
| ソナゾイド注射用 | ||
| ペメトレキセドナトリウム水和物 | 日本イーライリリー(株) | 平成19年1月22日 |
| アリムタ注射用500mg | ||
| レミフェンタニル塩酸塩 | ヤンセンファーマ(株) | 平成19年1月22日 |
| アルチバ静注用2mg, 同静注用5mg | ||
| インフリキシマブ(遺伝子組換え) | 田辺製薬(株) | 平成19年1月26日 |
| レミケード点滴静注用100*5 | ||
| ザナミビル水和物 | グラクソ・スミスクライン(株) | 平成19年1月26日 |
| リレンザ*6 | ||
| タクロリムス水和物 | アステラス製薬(株) | 平成19年1月26日 |
| プログラフカプセル0.5mg, 同カプセル1mg*7 | ||
| バクロフェン | 第一製薬(株) | 平成19年1月26日 |
| ギャバロン髄注0.005%, 同髄注0.05%, 同髄注0.2%*8 | ||
| ミカファンギンナトリウム | アステラス製薬(株) | 平成19年1月26日 |
| ファンガード点滴用25mg, 同点滴用50mg, 同点滴用75mg*9 | ||
| ルリオクトコグアルファ(遺伝子組換え) | バクスター(株) | 平成19年2月22日 |
| アドベイト注射用 250, 同注射用 500, 同注射用1000 |
| *1: | 初めに承認された成人用量 |
| *2: | 用法追加された「小児」 |
| *3: | 用法追加された「小児(7歳以上)」 |
| *4: | 効能追加された「手術後の循環動態監視下における下記の頻脈性不整脈に対する緊急処置:心房細動, 心房粗動, 洞性頻脈」 |
| *5: | 効能追加された「ベーチェット病による難治性網膜ぶどう膜炎(既存治療で効果不十分な場合に限る)」 |
| *6: | 効能追加された「A型又はB型インフルエンザ感染症の予防」 |
| *7: | 効能追加された「ループス腎炎(ステロイド剤の投与が効果不十分, 又は副作用により困難な場合)」 |
| *8: | 用法追加された「小児」 |
| *9: | 効能追加された「造血幹細胞移植患者におけるアスペルギルス症及びカンジダ症の予防」 |
参考資料
インフルエンザ治療に携わる医療関係者の皆様へ
(インフルエンザ治療開始後の注意事項についてのお願い)
標記について、各関係団体に周知を依頼するとともに、製造販売業者に対し、医療関係者への情報提供を指示しましたので、紹介します。
| (別添) | |
| 平成19年2月28日 厚 生 労 働 省 |
| インフルエンザ治療に携わる医療関係者の皆様へ (インフルエンザ治療開始後の注意事項についてのお願い) |
○ 今月に入り、抗インフルエンザウイルス薬リン酸オセルタミビル(販売名:タミフル)を服用したとみられる中学生が自宅で療養中、自宅マンションから転落死するという痛ましい事例が2例報道されております。これら2例については、現在、情報収集を行っており、タミフルの使用との関係を含め専門家による十分な検討を行うこととしております。
○ タミフルの使用と精神・神経症状の発現の関係については、別紙〔参考〕の2及び3に記載したように、これまで専門家による検討や調査を行ってきたところです。それらを踏まえると、タミフルの使用と精神・神経症状に起因するとみられる死亡との関係については否定的とされていることなどから、現段階でタミフルの安全性に重大な懸念があるとは考えておりませんが、今シーズンは更に詳細な検討を行うための調査を実施しております。
○ 以上のような状況の下において、現在のところタミフルと死亡との関係については否定的とされておりますが、インフルエンザウイルスに感染した場合、別紙〔参考〕の4のとおりタミフルの販売開始以前においても異常言動の発現が認められており、また、まれに脳炎・脳症を来すことがあるとの報告もなされていることから、以下の点について御配慮いただきたくお願いいたします。
万が一の事故を防止するための予防的な対応として、特に小児・未成年者については、インフルエンザと診断され治療が開始された後は、タミフルの処方の有無を問わず、異常行動発現のおそれがあることから、自宅において療養を行う場合、
このため、インフルエンザ治療に携わる医療関係者においては、患者・家族に対し、その旨説明を行っていただきたい。 |
| 別紙 |
| 〔参考〕 |
1 タミフルによる「精神・神経症状」については、因果関係は明確ではないものの、医療関係者に注意喚起を図る観点から、平成16年5月、添付文書の「重大な副作用」欄に「精神・神経症状(意識障害、異常行動、譫妄、幻覚、妄想、痙攣等)があらわれることがあるので、異常が認められた場合には投与を中止し、観察を十分に行い、症状に応じて適切な処置を行うこと。」と追記するとともに、医師、薬剤師等の医療関係者への情報提供等を行うよう、製造販売業者(中外製薬株式会社)に対し指示した。
2 異常行動によるものを含め、平成18年末までに、タミフルを服用した16歳以下の小児16例(治験時の1例を含む。)の死亡が報告されているが、薬事・食品衛生審議会医薬品等安全対策部会安全対策調査会における議論や、小児科、呼吸器科等の専門家からの意見聴取等によれば、これらについて、タミフルと死亡との関係は否定的とされている。
《平成17年度第1回薬事・食品衛生審議会医薬品等安全対策部会安全対策調査会(平成18年1月27日開催)参考資料4-4》
http://www.mhlw.go.jp/shingi/2006/01/dl/s0127-9d04.pdf
3 また、平成17年度厚生労働科学研究「インフルエンザに伴う随伴症状の発現状況に関する調査研究」(主任研究者:横田俊平(横浜市立大学大学院医学研究科発生成育小児医療学教授))の報告書によると、約2,800名の小児等を対象に、異常言動の発現について、タミフル未使用群とタミフル使用群を比較したところ、統計学的に有意な差は見られなかったと報告されている(より詳細な検討を行うため、今シーズンも調査が実施されている。)。
《厚生労働科学研究費補助金平成17年度分担研究報告書「インフルエンザに伴う随伴症状の発現状況に関する調査研究」》
http://www.mhlw.go.jp/topics/2006/10/dl/tp1020-2.pdf
4 さらに、タミフルの販売開始(平成13年2月)以前である平成11年1月から3月までを調査期間として行われた厚生省(当時)によるインフルエンザの臨床経過中に発生した脳炎・脳症の実態把握調査の報告によると、脳炎・脳症の状況及び経過として、意識障害、痙攣、異常行動等の精神・神経症状に係る記載が認められる。
《平成11年6月25日付け「インフルエンザの臨床経過中に発生した脳炎・脳症について」》
http://www1.mhlw.go.jp/houdou/1106/h0625-2_11.html
|
お知らせ 医薬品・医療機器等安全性情報は, 医薬品医療機器情報提供ホームページ(https://www.pmda.go.jp/)又は厚生労働省ホームページ(http://www.mhlw.go.jp/)からも入手可能です。 |
