目次
- 平成18年度のインフルエンザワクチンによる副作用の報告等について
- 使用上の注意の改訂について(その190)
(1)テリスロマイシン他(7件)
(2)内部流液管接続型ニードルレス機器他(1件) - 市販直後調査の対象品目一覧
この医薬品・医療機器等安全性情報は, 厚生労働省において収集された副作用等の情報をもとに, 医薬品・医療機器等のより安全な使用に役立てていただくために, 医療関係者に対して情報提供されるものです。
厚生労働省医薬食品局
| No. | 医薬品等 | 対策 | 情報の概要 |
|---|---|---|---|
| 1 | 平成18年度のインフルエンザワクチンによる副作用の報告等について | (症) | 平成18年度のインフルエンザワクチンによる副作用の報告状況等をまとめたので紹介する。 平成18年度のインフルエンザワクチンの推定使用量は, 約1,877万本であった。また, 薬事法に基づき報告された副作用は, 107症例, 149件であった。 主な副作用は, 急性散在性脳脊髄炎(白質脳脊髄炎)20件, 発熱11件, 発疹等8件, 注射部位の紅斑・腫脹等8件, 肝機能障害等7件, ショック・アナフィラキシー様症状7件, 痙攣6件, ギラン・バレー症候群4件などであった。 |
| 2 | (1)テリスロマイシン他(7件) (2)内部流液管接続型ニードルレス機器他(1件) |
使用上の注意の改訂について(その190) | |
| 3 | 市販直後調査対象品目 | 平成19年9月1日現在, 市販直後調査の対象品目一覧を紹介する。 |
(緊):緊急安全性情報の配布 (使):使用上の注意の改訂 (症):症例の紹介
|
厚生労働大臣への副作用等報告は, 医薬関係者の業務です。 医師, 歯科医師, 薬剤師等の医薬関係者は, 医薬品や医療機器による副作用, 感染症, 不具合を知ったときは, 直接又は当該医薬品等の製造販売業者を通じて厚生労働大臣へ報告してください。なお, 薬種商販売業や配置販売業の従事者も医薬関係者として, 副作用等につき, 報告することが求められています。 |
平成18年度のインフルエンザワクチンによる副作用の報告等について
(1)はじめに
インフルエンザワクチンによる副作用の報告等については, 平成15年度分より医薬品・医療用具等安全性情報No.205, 医薬品・医療機器等安全性情報No.217及びNo.228により紹介してきたところである。今般, 平成18年度のインフルエンザワクチンによる副作用の報告状況等をまとめたので紹介する。
(2)平成18年度のインフルエンザワクチンによる副作用の報告状況
平成18年度のインフルエンザワクチンの推定使用量は, 約1,877万本であった。また, 医薬品との因果関係が不明なものを含め, 製造販売業者等からインフルエンザワクチン接種によるものとして, 薬事法第77条の4の2第1項に基づき報告された副作用は, 107症例, 149件であった。過去4年間の推定使用量, 副作用報告数及び副作用報告件数を表1に, 平成18年度に報告されたインフルエンザワクチン接種による副作用について, 年代別・性別・転帰毎の報告数を表2に示す。
平成18年度に報告された主な副作用は, 急性散在性脳脊髄炎(白質脳脊髄炎)20件, 発熱11件, 発疹等8件, 注射部位の紅斑・腫脹等8件, 肝機能障害等7件, ショック・アナフィラキシー様症状7件, 痙攣6件, ギラン・バレー症候群4件などであった。このうち, 急性散在性脳脊髄炎の年度毎の副作用報告件数は, 平成16年度6件, 平成17年度4件, 平成18年度20件であるが, 副作用発現年度毎の件数は, 平成16年度9件, 平成17年度11件, 平成18年度7件であり, 過去3年間では大きな変化はなかった。
また, 平成18年度に報告のあった死亡症例及び後遺症症例について, その概要及び感染症, ウイルスの専門家からなるワクチン副反応検討会における因果関係の検討結果を, それぞれ表3及び表4に示す。
以上について, ワクチン副反応検討会で検討した結果, 新たな安全対策を講じる必要性は認められなかった。
なお, 薬事法に基づく副作用報告とは別に, 平成6年の予防接種法の改正に伴い実施されている予防接種後副反応報告制度がある。当該制度は, 予防接種法に基づく予防接種を受けた被接種者の健康状況の変化について, 予防接種実施要領に基づき情報を収集し広く国民に提供すること等を目的としたものであり, 報告対象は, 定期接種対象者のみとされている。平成18年度のインフルエンザワクチン接種による副反応報告件数(因果関係の有無にかかわらない報告)について, 参考として表5に示す。
表1 過去4年間のインフルエンザワクチンの推定使用量, 副作用報告数及び副作用報告件数
| 平成15年度 | 平成16年度 | 平成17年度 | 平成18年度 | |
| 推定使用量 | 約1,463万本 | 約1,598万本 | 約1,932万本 | 約1,877万本 |
| 副作用報告数 | 162症例 | 113症例 | 102症例 | 107症例 |
| 副作用報告件数 | 259件 | 205件 | 139件 | 149件 |
表2 インフルエンザワクチン接種による副作用報告症例の年代別・性別・転帰内訳
| 計 | 回復・軽快 | 未回復 | 不明 | 後遺症あり | 死亡 | |||||||
| 男 | 女 | 男 | 女 | 男 | 女 | 男 | 女 | 男 | 女 | 男 | 女 | |
| 報告症例数 | 107 | 72 | 5 | 17 | 8(5) | 5(0) | ||||||
| 51 | 56 | 32 | 40 | 3 | 2 | 9 | 8 | 3(2) | 5(3) | 4(0) | 1(0) | |
| 10歳未満 | 32 | 23 | 1 | 7 | 1(0) | |||||||
| 18 | 14 | 12 | 11 | 1 | 4 | 3 | 1(0) | |||||
| 10歳代 | 13 | 7 | 2 | 4(4) | ||||||||
| 9 | 4 | 5 | 2 | 2 | 2(2) | 2(2) | ||||||
| 20歳代 | 7 | 4 | 1 | 2 | ||||||||
| 1 | 6 | 1 | 3 | 1 | 2 | |||||||
| 30歳代 | 4 | 4 | ||||||||||
| 1 | 3 | 1 | 3 | |||||||||
| 40歳代 | 4 | 4 | ||||||||||
| 3 | 1 | 3 | 1 | |||||||||
| 50歳代 | 12 | 6 | 3 | 3(1) | ||||||||
| 4 | 8 | 2 | 4 | 2 | 1 | 3(1) | ||||||
| 60歳代 | 14 | 8 | 2 | 2 | 2(0) | |||||||
| 5 | 9 | 1 | 7 | 1 | 1 | 1 | 1 | 2(0) | ||||
| 70歳代 | 13 | 11 | 1 | 1(0) | ||||||||
| 9 | 4 | 7 | 4 | 1 | 1(0) | |||||||
| 80歳代 | 8 | 5 | 1 | 2(0) | ||||||||
| 1 | 7 | 5 | 1 | 1(0) | 1(0) | |||||||
| (注) | 1. | 「後遺症あり」, 「死亡」については, ( )内に報告された副作用とインフルエンザワクチン接種との因果関係が否定できないとされた件数を記載した。 |
| 2. | 複数の企業からそれぞれ報告された場合は, 重複してカウントしている。したがって, 表4の件数とは異なる。 |
表3 死亡症例の概要等
| No. | 症例の概要 | 検討会の検討結果 |
| 1 | 80代女性 副作用名:心筋梗塞 既往歴・合併症:虫垂切除, 高血圧 インフルエンザワクチン接種。接種時36.8℃であり, 患者の状態所見に異常なし。 その後も, 家族の話によると, 特に患者に変化なし。 接種6日後, 家族が浴場で倒れている患者を発見。病院に搬送されたが, 死亡。 |
既往歴や死亡に至った状況等の詳細情報が得られておらず, 情報不足のため, インフルエンザワクチン接種との因果関係は評価できない。 |
| 2 | 60代男性 副作用名:肺水腫, 肺炎 既往歴・合併症:高血圧 インフルエンザワクチン接種。接種後特に問題なし。 接種2日後, 深夜, 急に苦しみだしたとのことで, 救急外来来院。意識レベル低下, 不隠あり。 著明な低酸素血症と高炭酸ガス血症, アシドーシスの状態。胸部聴診にて湿性ラ音聴取。胸部X線写真上, 両肺透過性低下あり。白血球数の増加, CRPの上昇。人工呼吸管理開始, アシドーシス是正するも, 来院1時間後に心肺停止。 心臓マッサージ等により一旦心拍再開するも, 再度心肺停止。その後, 死亡。 |
接種から発症までの詳細情報が得られておらず, 情報不足のため, インフルエンザワクチン接種との因果関係は評価できない。 |
| 3 | 60代男性 副作用名:心肺停止, 低血糖症, 白血球減少症 既往歴・合併症:慢性腎不全, 慢性糸球体腎炎, 狭心症, 心筋梗塞, 骨盤骨折 14年前, 慢性糸球体腎炎が発症し, 8年前より, 血液透析開始。 透析時に, インフルエンザワクチン接種。接種後, 特段普段との変化を認めず。 接種2日後, 透析を実施。下痢症状あり, 明らかな圧痛なし。レボフロキサシン, 耐性乳酸菌製剤, ロペラミド塩酸塩を投与。 接種4日後, 透析を実施。 接種7日後, 明らかな発熱, 腹痛なし。倦怠感あり。透析施行。下痢は軽快。 接種8日後, 夕方, 自宅でいびきをかいて寝ていたが, その後, 家族が息をしていないのに気づき, 救急要請。心肺蘇生を開始するも, 反応なく, 死亡。 来院時, ショック, 白血球減少, 低血糖があり, 血液培養検査は施行ないが, 臨床症状から敗血症が疑われた。 死後のCTにて, 明らかな頭部, 腹部, 胸部の出血等なし。胸部CTにて, 両肺に軽度浸潤影あり。剖検所見なし。 |
接種8日後の突然死であるが, おそらく敗血症性ショック, 白血球減少, 低血糖にて死亡に至ったと考えられる。長期血液透析をされている患者であり, 原疾患による死亡の可能性も考えられるため, インフルエンザワクチン接種との因果関係は認められない。 |
| 4 | 70代男性 副作用名:発熱 既往歴・合併症:統合失調症, 便秘, 不眠症, パーキンソニズム, 激越 インフルエンザワクチン接種。接種当日37.7℃の発熱あり。 接種5日後, 再び39.6℃の発熱。ジクロフェナクナトリウム坐剤使用。36.7℃に解熱。 接種8日後, 39.2℃の発熱。ジクロフェナクナトリウム坐剤使用。37.2℃まで解熱。 接種10日後, 40.6℃の発熱。アセトアミノフェン服用。同日, 嘔吐あり。その後, 死亡。 |
接種当日及び接種5日後から発熱が続いており, 接種10日後に死亡に至った症例であるが, 発熱の原因及び死亡に至った状況等の詳細情報が得られておらず, 情報不足のため, インフルエンザワクチン接種との因果関係は評価できない。 |
| 5 | 80代男性 副作用名:肺炎, 発熱 既往歴・合併症:褥瘡性潰瘍 数年来寝たきりの状態。インフルエンザワクチン接種約2ヵ月前より, 褥瘡加療目的で入院。 インフルエンザワクチン接種。接種前の体温36.8℃, 脈拍72/分, 血圧110/82mmHg。 接種当日, 夕方より38℃台の発熱あり。 接種1日後, 39℃台の発熱が続くため, 急性肺炎と考え, メロペネム三水和物, ホスフルコナゾール, バンコマイシン塩酸塩投与。 その後, 数日経過したが解熱が得られず, 接種6日後, 呼吸停止, 死亡確認。 |
ワクチン接種直後からの発熱と肺炎であるが, 検査所見等の詳細情報が得られておらず, 情報不足のため, インフルエンザワクチン接種との因果関係は評価できない。 |
表4 後遺症症例の概要等
| No. | 症例の概要 | 検討会の検討結果 |
| 1 | 10代女性 副作用名:白質脳脊髄炎(急性散在性脳脊髄炎) 既往歴・合併症:なし インフルエンザワクチン1回目接種。1回目接種9日後, 2回目接種。 2回目接種24日後, 頭痛あり。また, 右手のしびれが増強し, 救急外来受診。鎮痛薬処方され帰宅。 2回目接種28日後, 全身倦怠感あり。 2回目接種29日後, 目がかすみはじめる。 2回目接種30日後, テレビの画像がわからなくなった。 2回目接種31日後, 眼科受診。 2回目接種32日後, 頭部MRI上, 急性散在性脳脊髄炎が考えられ, 同日入院。入院時よりステロイドパルス療法開始し, 3クール施行。徐々に視力は回復するも, 視力低下あり。 2回目接種38日後, 退院となりステロイド内服治療にて症状をおさえている状態。 |
ワクチン2回目接種24日後から神経症状が認められ, 急性散在性脳脊髄炎と診断されており, 他に神経症状を来す原因も見当たらないことから, インフルエンザワクチン接種との因果関係は否定できない。 |
| 2 | 10代男性 副作用名:複合性局所疼痛症候群(左手反射性交感神経性萎縮症) 既往歴・合併症:なし インフルエンザワクチン接種。接種直後は著変なし。 接種30~60分後, 左上腕から手指のしびれ感, 冷感を自覚し受診。 受診時, 意識清明, 左前腕筋力低下, 皮膚温の著明な低下あり。とう骨動脈の触知は良好。末梢循環障害を疑う。 他院にて左手反射性交感神経性萎縮症の診断を受け, 同日入院。ステロイド, ビタミン剤等の補液及び安静加療を行う。 接種3日後, 退院。退院時, 左手脱力, 冷感は改善したが, 持続していた。以後, 外来でリハビリ施行。 接種約5ヵ月後, 脱力が持続し, 通院中。 |
ワクチン接種1時間以内に発症と発症時期が比較的早いこと, 患者が運動選手であり筋肉疲労等があった可能性があることから他の要因も否定できないが, ワクチン接種側の腕に発症しており, インフルエンザワクチン接種との因果関係も否定できない。 |
| 3 | 50代女性 副作用名:脳血管炎 既往歴・合併症:なし インフルエンザワクチン接種。 接種約2週間後, かぜ症状あり。微熱・咳・鼻汁・嘔気・拍動性頭痛に加え, 左顔面・上肢のしびれ感が出現し受診。 受診10日後, 見当識正常であったが, 記銘力障害・構成失行・左右失認・失計算・着衣失行あり。 血液検査では赤沈亢進以外は異常なし。髄液検査ではリンパ球増多あるが, 各種ウイルス抗体・DNAは陰性。 受診12日後, 左上肢・左口角のしびれ。 受診13日後, 入院。MRI拡散強調画像では両側後頭葉皮質・皮質下に高信号域を認め, MRA及び脳血管撮影では両側前・中・後大脳動脈にソーセージ様の血管狭窄・拡張あり。髄液検査・脳血管撮影所見から脳血管炎と診断。 受診17日後より, ステロイドパルス療法, シロスタゾールによる処置施行し, 症状及び脳血管炎は改善したが, 両側後頭葉に不可逆的障害が残存。 受診43日後, 退院。記銘力障害の後遺症あり。 |
ワクチン接種後に発症しているが, ワクチン接種後に罹患した感染等の影響も考えられる。ワクチン接種及び接種後の感染発症から脳血管炎発症までの詳細情報が得られておらず, 情報不足のため, インフルエンザワクチン接種との因果関係は評価できない。 |
| 4 | 10歳未満男性 副作用名:顔面神経麻痺 既往歴・合併症:精神運動機能障害, 上気道の炎症, ヘルペス性歯肉口内炎 インフルエンザワクチン接種。 接種4日後, 左口角下垂, 左閉眼困難あり。左顔面神経麻痺が発現。 接種5日後, 受診。左顔面神経麻痺, 両側中耳炎と診断。頭部CTに異常なし。 接種6日後, 無治療で経過観察。 接種8日後, 中耳炎に対して抗菌薬処方。 接種18日後, 顔面麻痺は回復の兆しあり。鼓膜発赤が続き, 抗菌薬を変更。 接種34日後, 左閉眼可能となったが, 鼓膜発赤が続き, 側頭骨CT検査では異常なし。中耳炎に対する治療は終了。 接種79日後, 表情の左右差が目立つ。 接種115日後, 水痘ワクチンを接種したところ, その後, 左眼瞼の腫脹(浮腫)が出現し, 瞼裂の左右差がはっきりした。 接種211日後, 泣いたときに, 特に顔面の非対称が目立つ。左眼瞼の下垂も続いている。 |
ワクチン接種後に発症している。しかし, 接種前のヘルペスウイルス感染, 接種後の中耳炎等の他の要因の可能性も考えられるため, インフルエンザワクチン接種との因果関係は評価できない。 |
| 5 | 10代男性 副作用名:ギラン・バレー症候群 既往歴・合併症:なし インフルエンザワクチン接種。 接種6日後, 右半身優位に筋力低下。感覚麻痺。ギラン・バレー症候群が発現。 接種7日後, 複視あり。 接種9日後, 両下肢の末梢神経伝達速度低下あり。 接種12日後, ガンマグロブリン投与開始。数時間後より, 筋力回復傾向, 麻痺消失。 接種16日後, 頭痛のみ持続するが, 麻痺消失。 |
ワクチン接種6日後から神経症状が認められており, 他に神経疾患を発症する要因もないため, インフルエンザワクチン接種との因果関係は否定できない。 |
| 6 | 50代女性 副作用名:白質脳脊髄炎(急性散在性脳脊髄炎) 既往歴・合併症:食物アレルギー, 尿管結石 インフルエンザワクチン接種。 接種17日後, 肛門部右側に刺すような痛みあり。 接種20日後頃, 腰から大腿部後面のズキンという痛みが間欠的にあり, 次第に回数が増悪。 接種34日後, 入院。 接種35日後から両大腿部の脱力を自覚。次第に増悪。 接種37日後, 自力歩行不能。両下肢の感覚の鈍さが出現。 接種44日後, 前胸部以下の感覚がほとんどなくなった。この頃より腰から下腿の痛みも消失したが, 脱力は増悪。ほとんど自力で足を動かすことはできなくなった。 接種103日後, ステロイドパルス療法, 血漿交換療法にて治療中。 |
ワクチン接種17日後から神経症状が認められ, 急性散在性脳脊髄炎と診断されており, 他に神経症状を来す原因も見当たらないことから, インフルエンザワクチン接種との因果関係は否定できない。 |
表5 平成18年度インフルエンザワクチンにおける副反応報告(因果関係の有無にかかわらない報告)
| 総数 | 治癒 | 死亡 | 重篤 | 入院 | 後遺症 | その他 | 記入無 | |
| 総数 | 26 | 2 | 1 | 1 | 5 | 1 | 12 | 4 |
| 1 即時性全身反応 | 2 | 1 | 1 | |||||
| 1A アナフィラキシー | 2 | 1 | 1 | |||||
| 1B 全身蕁麻疹 | ||||||||
| 2 脳炎, 脳症 | ||||||||
| 3 けいれん | 2 | 1 | 1 | |||||
| 4 運動障害 | ||||||||
| 5 その他の神経障害 | 1 | 1 | ||||||
| 6 局所の異常腫脹(肘を越える) | ||||||||
| 7 全身の発疹 | 1 | 1 | ||||||
| 8 39℃以上の発熱 | 4 | 1 | 3 | |||||
| 9 その他の異常反応 | 1 | 1 | ||||||
| 10 基準外報告 | 15 | 1 | 1 | 1 | 2 | 7 | 3 | |
| 10A 局所反応(発赤腫脹等) | 6 | 1 | 4 | 1 | ||||
| 10B 全身反応(発熱等) | 3 | 1 | 2 | |||||
| 10C その他 | 6 | 1 | 3 | 2 |
(注)表記の数値は暫定のものであり, 今後一部変更となる可能性がある。
使用上の注意の改訂について(その190)
(1)医薬品等
平成19年8月8日及び8月10日に改訂を指導した医薬品の使用上の注意について, 改訂内容, 主な該当販売名等をお知らせいたします。
| 1 | 〈主としてグラム陽性菌, マイコプラズマに作用するもの〉 テリスロマイシン |
|
| [販売名] | ケテック錠300mg(サノフィ・アベンティス) | |
| [警告] |
|
|
| [禁忌] |
|
|
| [用法及び用量に 関連する使用上の 注意] |
意識消失や視覚障害があらわれることがあるので, 原則として就寝前に服用させること。 | |
| [副作用 (重大な副作用)] |
重症筋無力症の悪化:重症筋無力症の患者で症状の悪化が報告されている。呼吸器感染症に本剤を投与し, 急性呼吸不全を起こした致死的な例も報告されている。 |
| 2 | 〈甲状腺, 副甲状腺ホルモン剤〉 乾燥甲状腺, レボチロキシンナトリウム水和物 |
|
| [販売名] | チラーヂン末(あすか製薬)他 チラーヂンS散, 同S錠25, 同S錠50, 同S錠100(あすか製薬), レボチロキシンNa錠25μg「サンド」, 同錠50μg「サンド」(サンド) |
| [副作用 (重大な副作用)] |
肝機能障害, 黄疸:AST(GOT), ALT(GPT), γ-GTP等の著しい上昇, 発熱, 倦怠感等を伴う肝機能障害, 黄疸があらわれることがあるので, 観察を十分に行い, 異常が認められた場合には投与を中止するなど適切な処置を行うこと。 |
| 3 | 〈その他のホルモン剤〉 シクロフェニル |
|
| [販売名] | セキソビット(あすか製薬) |
| [副作用 (重大な副作用)] |
肝機能障害, 黄疸:AST(GOT), ALT(GPT), γ-GTP等の上昇, 発熱, 倦怠感等を伴う肝機能障害, 黄疸があらわれることがあるので, 観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 |
| 4 | 〈その他の泌尿生殖器官及び肛門用薬〉 シロドシン |
|
| [販売名] | ユリーフカプセル2mg, 同カプセル4mg(キッセイ薬品工業) |
| [副作用 (重大な副作用)] |
肝機能障害, 黄疸:AST(GOT)上昇, ALT(GPT)上昇等を伴う肝機能障害, 黄疸があらわれることがあるので, 観察を十分に行い, 異常が認められた場合には, 投与を中止するなど, 適切な処置を行うこと。 |
| 5 | 〈習慣性中毒用剤〉 ジスルフィラム |
|
| [販売名] | ノックビン(三菱ウェルファーマ) |
| [副作用 (重大な副作用)] |
肝機能障害, 黄疸:AST(GOT), ALT(GPT), γ-GTP, LDH, Al-P, ビリルビン等の上昇を伴う肝機能障害, 黄疸があらわれることがあるので, 定期的に肝機能検査を行うなど観察を十分に行い, 異常が認められた場合には投与を中止するなど適切な処置を行うこと。 |
| 6 | 〈抗ウイルス剤〉 エンテカビル水和物 |
|
| [販売名] | バラクルード錠0.5mg(ブリストル・マイヤーズ) |
| [重要な基本 的注意] |
抗HIV療法を受けていないHIV/HBVの重複感染患者のB型肝炎に対して本剤を投与した場合, 薬剤耐性HIVが出現する可能性があるため, 抗HIV療法を併用していないHIV/HBV重複感染患者には本剤の投与を避けることが望ましい。 |
| 7 | 〈ワクチン類〉 組換え沈降B型肝炎ワクチン(酵母由来) |
|
| [販売名] | ビームゲン(化学及血清療法研究所), ヘプタバックス-II(萬有製薬) |
| [副反応 (重大な副反応)] |
ショック, アナフィラキシー様症状:ショック, アナフィラキシー様症状(血圧低下, 呼吸困難, 顔面蒼白等)があらわれることがあるので, 接種後は観察を十分に行い, 異常が認められた場合には適切な処置を行うこと。 |
| 8 | 〈混合生物学的製剤〉 乾燥弱毒生麻しん風しん混合ワクチン |
|
| [販売名] | 乾燥弱毒生麻しん風しん混合ワクチン「タケダ」(武田薬品工業), ミールビック(阪大微生物病研究会) |
| [副反応] | 「以下の副反応は, 乾燥弱毒生麻しんワクチンあるいは乾燥弱毒生風しんワクチンの添付文書に記載されている副反応情報である。」を削除 |
| [副反応 重大な副反応] |
脳炎:脳炎の発生が報告されている。異常が認められた場合には適切な処置を行うこと。 けいれん:熱性けいれんを起こすことがある。異常が認められた場合には適切な処置を行うこと。 |
(2)医療機器
平成19年8月3日に改訂を指導した医療機器の使用上の注意について, 改訂内容等をお知らせいたします。
| 1 | 内部流液管接続型ニードルレス機器(当該機器の接続部のバルブが, 接続しようとする輸液セット等の先端により押し下げられることにより, 内部にある流液管と輸液セット等が接続され, 流液路が開通するもの。図1及び図2を参照。) | |
| [使用上の注意 (相互作用)] |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 参考 ルアーロック付きプレフィルドシリンジ製剤の先端の内径寸法から, 内部流液管接続型のニードルレス機器と接続できないことが判明している製品 (平成19年8月3日現在)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | スリット開口型ニードルレス機器(当該機器の接続部のバルブが, 接続しようとする輸液セット等の先端により押し拡げられることにより, バルブにスリット(切り口)が開口し, 流液路が開通するもの。図1及び図3を参照。) | |
| [使用上の注意 (相互作用)] |
|
||
図1 ニードルレス機器の使用部位例 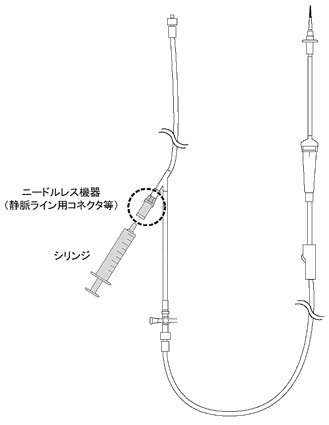 |
|||
図2 内部流液管接続型ニードルレス機器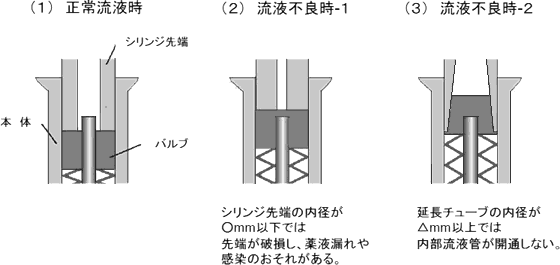 |
|||
図3 スリット開口型ニードルレス機器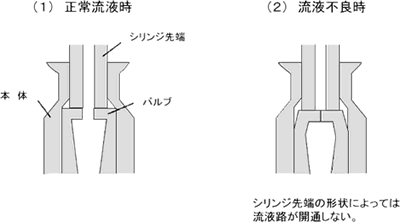 |
|||
市販直後調査の対象品目一覧
| (平成19年9月1日現在) |
| 一般名 | 製造販売業者名 | 市販直後調査開始年月日 |
| 販売名 | ||
| フォリトロピンベータ(遺伝子組換え) | 日本オルガノン(株) | 平成19年3月16日 |
| フォリスチム注50, 同注75*1 | ||
| ペグインターフェロンアルファ-2a(遺伝子組換え) | 中外製薬(株) | 平成19年3月16日 |
| ペガシス皮下注90μg, 同皮下注180μg*2 | ||
| リバビリン | 中外製薬(株) | 平成19年3月16日 |
| コペガス錠200mg | ||
| モダフィニル | アルフレッサファーマ(株) | 平成19年3月28日 |
| モディオダール錠100mg | ||
| レボノルゲストレル放出子宮内避妊システム | バイエル薬品(株) | 平成19年4月16日 |
| ミレーナ52mg | ||
| 塩酸バラシクロビル | グラクソ・スミスクライン(株) | 平成19年4月18日 |
| バルトレックス顆粒50%*3 | ||
| エンタカポン | ノバルティスファーマ(株) | 平成19年4月19日 |
| コムタン錠100mg | ||
| ペグビソマント(遺伝子組換え) | ファイザー(株) | 平成19年6月5日 |
| ソマバート皮下注用10mg, 同皮下注用15mg, 同皮下注用20mg | ||
| サルメテロールキシナホ酸塩・フルチカゾンプロピオン酸エステル | グラクソ・スミスクライン(株) | 平成19年6月8日 |
| アドエア100ディスカス, 同250ディスカス, 同500ディスカス | ||
| シクレソニド | 帝人ファーマ(株) | 平成19年6月8日 |
| オルベスコ50μgインヘラー112吸入用, 同100μgインヘラー112吸入用, 同200μgインヘラー56吸入用 | ||
| フォンダパリヌクスナトリウム | グラクソ・スミスクライン(株) | 平成19年6月8日 |
| アリクストラ皮下注1.5mg, 同皮下注2.5mg | ||
| イミダフェナシン | 杏林製薬(株) | 平成19年6月11日 |
| ウリトス錠0.1mg | ||
| イミダフェナシン | 小野薬品工業(株) | 平成19年6月11日 |
| ステーブラ錠0.1mg | ||
| エゼチミブ | シェリング・プラウ(株) | 平成19年6月11日 |
| ゼチーア錠10mg | ||
| ベバシズマブ(遺伝子組換え) | 中外製薬(株) | 平成19年6月11日 |
| アバスチン点滴静注用100mg/4mL, 同点滴静注用400mg/16mL | ||
| セレコキシブ | アステラス製薬(株) | 平成19年6月12日 |
| セレコックス錠100mg, 同錠200mg | ||
| リセドロン酸ナトリウム水和物 | 味の素(株) | 平成19年6月15日 |
| アクトネル錠17.5mg | ||
| リセドロン酸ナトリウム水和物 | 武田薬品工業(株) | 平成19年6月15日 |
| ベネット錠17.5mg | ||
| リン酸二水素ナトリウム一水和物・無水リン酸水素二ナトリウム | ゼリア新薬工業(株) | 平成19年6月15日 |
| ビジクリア錠 | ||
| 塩酸アミオダロン | サノフィ・アベンティス(株) | 平成19年6月22日 |
| アンカロン注150 | ||
| カルテオロール塩酸塩 | 大塚製薬(株) | 平成19年7月3日 |
| ミケランLA点眼液1%, 同LA点眼液2% | ||
| ダルベポエチンアルファ(遺伝子組換え) | キリンファーマ(株) | 平成19年7月9日 |
| ネスプ静注用10μgシリンジ, 同静注用15μgシリンジ, 同静注用20μgシリンジ, 同静注用30μgシリンジ, 同静注用40μgシリンジ, 同静注用60μgシリンジ, 同静注用120μgシリンジ | ||
| リン酸フルダラビン | バイエル薬品(株) | 平成19年7月12日 |
| フルダラ錠10mg | ||
| エストラジオール | (株)資生堂 | 平成19年8月9日 |
| ル・エストロジェル0.06% |
| *1: | 効能追加された「視床下部-下垂体機能障害に伴う無排卵及び希発排卵における排卵誘発」 |
| *2: | 効能追加された「リバビリンとの併用による以下のいずれかのC型慢性肝炎におけるウイルス血症の改善(1)セログループ1(ジェノタイプI(1a)又はII(1b))でHCV-RNA量が高値の患者(2)インターフェロン単独療法で無効又はインターフェロン単独療法後再燃した患者」 |
| *3: | 効能追加された「水痘」 |
|
お知らせ 医薬品・医療機器等安全性情報は, 医薬品医療機器情報提供ホームページ(https://www.pmda.go.jp/)又は厚生労働省ホームページ(http://www.mhlw.go.jp/)からも入手可能です。 |
