目次
- インターフェロン製剤によるウイルス性肝炎治療にあたって
- 非麦角系ドパミンアゴニストによる突発的睡眠等について
(自動車の運転等をさせないことの患者説明の徹底) - 重要な副作用等に関する情報
【1】 シクロホスファミド(経口剤), シクロホスファミド(注射剤) - 使用上の注意の改訂について(その195)
ニコランジル(経口剤)他(1件) - 市販直後調査の対象品目一覧
この医薬品・医療機器等安全性情報は, 厚生労働省において収集された副作用等の情報をもとに, 医薬品・医療機器等のより安全な使用に役立てていただくために, 医療関係者に対して情報提供されるものです。
厚生労働省医薬食品局
| No. | 医薬品等 | 対策 | 情報の概要 |
|---|---|---|---|
| 1 | インターフェロン製剤によるウイルス性肝炎治療にあたって | インターフェロン製剤によるウイルス性肝炎治療については, 早ければ本年4月より医療費助成が開始されるため, 当該治療患者の増加が予想される。同製剤によるウイルス性肝炎治療にあたり, 特に副作用に関して改めて注意を促すため, その種類や発現状況等についてとりまとめたので紹介する。 | |
| 2 | 非麦角系ドパミンアゴニストによる突発的睡眠等について(自動車の運転等をさせないことの患者説明の徹底) | (使)(症) | 非麦角系ドパミンアゴニストである塩酸プラミペキソール水和物, 塩酸ロピニロール及び塩酸タリペキソールについては, 従前より突発的睡眠等がみられることがあることから, 自動車の運転等危険を伴う作業に従事しないよう注意する旨を使用上の注意に記載し, 注意喚起してきたところである。しかしながら, これらの非麦角系ドパミンアゴニスト服用中に自動車の運転をして, 突発的睡眠等により自動車事故を起こした事例が報告されたことから, 患者への説明を更に徹底するため, 使用上の注意の改訂指示等行ったので, その安全対策について紹介する。 |
| 3 | シクロホスファミド(経口剤), シクロホスファミド(注射剤) | (使)(症) | 平成20年2月12日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容とともに改訂の根拠となった症例の概要等に関する情報を紹介する。 |
| 4 | ニコランジル(経口剤)他(1件) | 使用上の注意の改訂について(その195) | |
| 5 | 市販直後調査対象品目 | 平成20年3月1日現在, 市販直後調査の対象品目一覧を紹介する。 |
|
厚生労働大臣への副作用等報告は, 医薬関係者の業務です。 医師, 歯科医師, 薬剤師等の医薬関係者は, 医薬品や医療機器による副作用, 感染症, 不具合を知ったときは, 直接又は当該医薬品等の製造販売業者を通じて厚生労働大臣へ報告してください。なお, 薬種商販売業や配置販売業の従事者も医薬関係者として, 副作用等につき, 報告することが求められています。 |
インターフェロン製剤によるウイルス性肝炎治療にあたって
| 成分名 販売名(会社名) |
成分名 | 販売名(会社名) | |||||||||||||||||||||
| インターフェロンアルファコン-1(遺伝子組換え) | アドバフェロン皮下注900, 同皮下注1200, 同皮下注1800(アステラス製薬) | ||||||||||||||||||||||
| インターフェロン アルファ(BALL-1) | オーアイエフ250万IU, 同500万IU, 同1000万IU(大塚製薬) | ||||||||||||||||||||||
| インターフェロン アルファ(NAMALWA) | スミフェロン300, 同600, 同DS300, 同DS600(大日本住友製薬) | ||||||||||||||||||||||
| インターフェロンアルファ-2b(遺伝子組換え) | イントロンA注射用300, 同A注射用600, 同A注射用1,000(シェリング・プラウ) | ||||||||||||||||||||||
| インターフェロン ベータ | IFNβモチダ注射用100万単位, 同注射用300万単位, 同注射用600万単位(持田製薬), フエロン(東レ) | ||||||||||||||||||||||
| ペグインターフェロン アルファ-2a(遺伝子組換え) | ペガシス皮下注90μg, 同皮下注180μg (中外製薬) | ||||||||||||||||||||||
| ペグインターフェロンアルファ-2b(遺伝子組換え) | ペグイントロン皮下注用50μg/0.5mL用, 同皮下注用100μg/0.5mL用, 同皮下注用150μg/0.5mL用(シェリング・プラウ) | ||||||||||||||||||||||
| 薬効分類等 | その他の生物学的製剤 | ||||||||||||||||||||||
| 効 能 効 果 | インターフェロンアルファコン-1(遺伝子組換え)
(スミフェロン300, 同600, 同DS300, 同DS600)
リバビリンとの併用による次のいずれかのC型慢性肝炎におけるウイルス血症の改善
|
||||||||||||||||||||||
1.はじめに
インターフェロン製剤によるウイルス性肝炎治療については, 早ければ本年4月より医療費助成が開始されるため, 当該治療患者の増加が予想される。同製剤によるウイルス性肝炎治療にあたり, 特に副作用に関して改めて注意を促すため, その種類や発現状況等についてとりまとめたので紹介する。
2.インターフェロン製剤によるウイルス性肝炎治療
B型あるいはC型ウイルス性肝炎の治療に用いられるインターフェロン製剤にはインターフェロンアルファ, インターフェロンベータ, コンセンサスインターフェロン(アルファコン), ペグインターフェロンがあり, それぞれ抗ウイルス効果や適応症, 副作用の傾向等が異なる。患者の体質や病状(ウイルスの型や量)に応じ, 治療方法が選択される。また, インターフェロンアルファの一部とペグインターフェロンにおけるC型肝炎治療には抗ウイルス剤リバビリンとの併用がなされる場合もある。
インターフェロン製剤による治療開始初期は, 同製剤の減量や中止を必要とする中等度から重度の副作用が報告されているので, 例えば, 重度の副作用を発現する可能性の高い患者は, 投与開始から2週間は原則入院させて治療を行うことがある。
慢性肝炎の診療に関しては, 以下のガイドライン等が示されている。
「慢性肝炎診療のためのガイドライン」(http://www.jsh.or.jp/medical/guidelines/index.html:日本肝臓学会)
「都道府県における肝炎検査後肝疾患診療体制に関するガイドライン」(全国C型肝炎診療懇談会報告書)(http://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou09/03.html#top)
厚生労働科学研究費補助金 肝炎等克服緊急対策研究事業「B型及びC型肝炎ウイルスの感染者に対する治療の標準化に関する臨床的研究」(平成17年度総括・分担研究報告書)(http://mhlw-grants.niph.go.jp/niph/search/NIDD00.do)
3.使用上の注意について
インターフェロン製剤については, その投与により間質性肺炎, 自殺企図等の重篤な副作用が発現することがあるので, 添付文書に警告, 禁忌, 重要な基本的注意, 重大な副作用等の「使用上の注意」の記載に十分留意する必要があるので, 主な記載事項を以下に示す。
なお, 各製剤の「使用上の注意」は, (独)医薬品医療機器総合機構の医薬品医療機器情報提供ホームページの「医療用医薬品添付文書情報」から入手可能である。
インターフェロン製剤の投与により間質性肺炎, 自殺企図があらわれることがあるので, 「使用上の注意」に十分留意し, 患者に対し副作用発現の可能性について十分説明する。
(2)禁忌
| 次の患者には投与しない。 | ||||||||||||
|
(3)重大な副作用
インターフェロン製剤による治療中に起こる副作用のうち, 重篤なものとして, 間質性肺炎, 自殺企図及び抑うつ, 血小板数減少による出血傾向, 脳出血等があるが, これらは入院等の加療が必要となり, 中には死に至る場合もある。特に, 間質性肺炎と自殺企図については, 全てのインターフェロン製剤において警告の欄に記載され, 注意喚起がなされている。
その他, 重大な副作用として, 自己免疫現象(甲状腺機能異常, 自己免疫性肝炎, 溶血性貧血, 潰瘍性大腸炎, 関節リウマチ, インスリン依存型糖尿病, SLE, 重症筋無力症, 多発性筋炎の増悪又は発症等), 糖尿病, 血栓性血小板減少性紫斑病(TTP), 溶血性尿毒症症候群(HUS), 重篤な肝障害, 重篤な腎障害(急性腎不全, ネフローゼ症候群等), ショック, 重篤な心疾患(心不全, 狭心症, 心筋梗塞, 完全房室ブロック, 心室頻拍, 心筋症, 心内膜炎等), 重篤な中枢・精神神経系障害(意識障害, 錯乱, 興奮, 見当識障害, 失神, 痙攣, せん妄, 躁状態, 幻覚/妄想, 痴呆様症状等), 網膜症, 敗血症, 脳梗塞, 消化管出血, 消化性潰瘍, 虚血性大腸炎, スティーブンス・ジョンソン症候群, 中毒性表皮壊死症, 多型紅斑, 乾癬, 横紋筋融解症, 呼吸困難, 肺線維症, 肺水腫, 不整脈, 再生不良性貧血, 汎血球減少, 無顆粒球症, 白血球減少, 貧血, 重篤な皮膚潰瘍等が挙げられている。
(4)よく見られる副作用
インターフェロン治療中には様々な副作用がみられる。発現頻度の高い副作用としては, インフルエンザ様症状(発熱, 頭痛, 倦怠感, 関節痛等), 血液検査異常値(ヘモグロビン減少, 血小板減少, 白血球減少等), 脱毛, そう痒, 腹痛, 食欲不振, 下痢, 悪心・嘔吐, 注射部位の炎症やそう痒, 不眠等が挙げられる。主な副作用の発現頻度については参考に示す。
また, 治療開始からの時期によってみられる副作用が異なることも知られている。これらのほとんどは一時的なもので, 通常, 薬剤の減量や中止によって副作用を軽減できる。
|
(5)リバビリン併用における副作用
抗ウイルス剤リバビリンは, ペグインターフェロンアルファ-2a(遺伝子組換え), インターフェロンアルファ-2b(遺伝子組換え)又はペグインターフェロンアルファ-2b(遺伝子組換え)において併用される。
リバビリンの副作用としては, 催奇形性が問題となる。リバビリンには動物実験で催奇形性作用及び胚・胎児致死作用が報告されているので, 妊婦又は妊娠している可能性のある婦人には投与しないこととされている。また, 精巣・精子の形態変化等が報告されているので, パートナーが妊娠する可能性のある男性患者に投与する場合には, 避妊をさせることとされている。
また, 併用した場合の副作用は, 主にインターフェロンアルファ製剤の副作用と同様である。
4.おわりに
医療関係者においては, インターフェロン製剤による治療等にあたって, その副作用を早期に発見し対応するため, 患者を十分に観察するとともに, 投与に際し, 患者に副作用の初期症状等を含め治療等に関する十分な説明をお願いする。
また, 患者用の説明資材として, (独)医薬品医療機器総合機構の医薬品医療機器情報提供ホームページへ, 間質性肺炎等一部の重篤な副作用(注)に関しては「重篤副作用疾患別対応マニュアル」を, インターフェロン製剤に関しては「患者向医薬品ガイド」を掲載しているので, 患者への説明の際にご活用いただきたい。
| (注) | スティーブンス・ジョンソン症候群, 中毒性表皮壊死症, 急性腎不全, 再生不良性貧血, 薬剤性貧血, 出血傾向, 無顆粒球症, 血小板減少症, 間質性肺炎 |
<参考> 各インターフェロン製剤における主な副作用
| (注) | 比較的発現頻度の高い副作用を掲載した。頻度不明でも重篤な副作用が発現しうることから, 各製剤の使用上の注意を併せてご確認願いたい。 なお, 各副作用の発現頻度の詳細については各製剤のインタビューフォーム等を参照されたい。 |
●インターフェロンアルファ(NAMALWA)「スミフェロン(R)」, 「スミフェロン(R)DS」
(出典:スミフェロン(R)の医薬品インタビューフォーム2007年12月改訂版からの抜粋)
| B型慢性活動性肝炎 | C型慢性肝炎 | ||||||
| 承認時まで の調査 |
使用成績 調査 |
承認時まで の調査 |
使用成績 調査*1 |
市販後 臨床試験*2 |
特別調査*3 | 市販後 臨床試験*4 |
|
| 調査例数 | 214 | 1,496 | 544 | 3,368 | 275 | 343 | 107 |
| 副作用等の発現症例数 | 194 | 990 | 471 | 1,628 | 243 | 240 | 105 |
| 副作用等の発現症例率 | 90.7% | 66.2% | 86.6% | 48.3% | 88.4% | 70.0% | 98.1% |
| 主な副作用 | |||||||
| 発熱 | 79.0% | 55.4% | 66.4% | 29.3% | 70.9% | 61.2% | 73.8% |
| 全身倦怠(感) | 5.1% | 3.8% | 15.3% | 2.6% | 5.6% | ||
| 倦怠(感) | 21.5% | 7.2% | 7.2% | 1.7% | 0.7% | 1.7% | 44.9% |
| 悪寒 | 1.9% | 1.5% | 1.3% | 0.1% | 2.2% | 0.3% | 5.6% |
| 頭痛 | 17.8% | 5.3% | 12.7% | 2.3% | 16.7% | 3.5% | 40.2% |
| 白血球減少(症) | 43.5% | 22.0% | 29.6% | 9.4% | 22.5% | 11.7% | 61.7% |
| 血小板減少(症) | 34.6% | 20.3% | 27.9% | 12.9% | 24.4% | 18.4% | 43.0% |
| 顆粒球減少(症) | 8.9% | 0.8% | 1.5% | 0.3% | 0.7% | 0.3% | 0.9% |
| 貧血 | 1.0% | 0.5% | 0.7% | 0.3% | |||
| 好中球減少 | 5.7% | 0.2% | 5.8% | 1.7% | 32.7% | ||
| 脱毛(症) | 11.2% | 4.8% | 8.8% | 7.3% | 8.4% | 4.7% | 27.1% |
| 発疹 | 2.8% | 1.3% | 0.9% | 0.7% | 0.9% | 7.5% | |
| 関節痛 | 7.9% | 2.7% | 6.6% | 2.5% | 15.6% | 3.5% | 29.9% |
| 筋肉痛 | 5.6% | 1.1% | 3.5% | 1.2% | 2.5% | 1.2% | 12.1% |
| 嘔気 | 4.7% | 2.1% | 0.6% | 0.6% | 3.6% | 0.6% | 5.6% |
| 下痢 | 1.4% | 1.2% | 0.9% | 0.6% | 0.6% | 15.0% | |
| 食欲不振 | 19.2% | 4.7% | 5.7% | 2.0% | 0.7% | 3.5% | 22.4% |
| AST(GOT)上昇 | 2.8% | 2.1% | 1.1% | 0.2% | 1.1% | 0.9% | 3.7% |
| ALT(GPT)上昇 | 2.8% | 2.3% | 1.1% | 0.3% | 1.1% | 2.0% | 3.7% |
*1:C型慢性活動性肝炎の使用成績調査 *2:C型慢性活動性肝炎の市販後臨床試験
*3:C型慢性肝炎の特別調査 *4:C型慢性肝炎の市販後臨床試験
●インターフェロンアルファ(BALL-1)「オーアイエフ(R)」
(出典:オーアイエフ(R)の医薬品インタビューフォーム2006年12月改訂版)
| B型慢性活動性肝炎 | C型慢性肝炎 | ||||||
| 承認時 | 使用成績 調査 |
CAH 承認時*1 |
CAH 使用成績調査*2 |
CAH市販後 臨床試験*3 |
CPH 承認時*4 |
小児C肝 承認時*5 |
|
| 調査例数 | 295 | 515 | 1,109 | 1,298 | 110 | 196 | 38 |
| 副作用等の発現症例数 | 264 | 397 | 888 | 1,159 | 110 | 181 | 23 |
| 副作用等の発現症例率 | 89.5% | 77.1% | 80.1% | 89.3% | 100.0% | 92.3% | 60.5% |
| 主な副作用 | |||||||
| 発熱 | 79.3% | 71.8% | 63.2% | 76.4% | 97.3% | 79.1% | 52.6% |
| 倦怠(感) | 0.2% | 3.1% | 13.6% | ||||
| 全身倦怠(感) | 14.6% | 2.3% | 15.5% | 9.9% | 1.8% | 13.3% | |
| 悪寒 | 4.1% | 0.2% | 0.8% | 0.8% | 0.9% | 0.5% | |
| 頭痛 | 14.9% | 3.5% | 5.7% | 7.6% | 10.0% | 11.7% | 5.3% |
| 不眠 | 0.6% | 0.4% | 4.3% | 4.5% | 1.0% | ||
| 抑うつ状態 | 0.4% | 1.0% | 6.2% | 5.5% | 1.5% | ||
| 貧血 | 1.7% | 1.0% | 0.3% | 2.2% | 0.9% | ||
| 脱毛 | 3.7% | 1.6% | 8.7% | 11.9% | 7.3% | 13.8% | 5.3% |
| 発疹 | 2.0% | 0.4% | 1.3% | 1.8% | 2.6% | ||
| 関節痛 | 8.1% | 3.1% | 5.5% | 7.8% | 15.5% | 15.3% | 2.6% |
| 筋肉痛 | 0.7% | 2.1% | 2.9% | 3.1% | 4.5% | 6.1% | 2.6% |
| 嘔気 | 1.0% | 1.6% | 2.0% | 1.8% | 2.6% | 2.6% | |
| 嘔吐 | 1.0% | 0.4% | 0.2% | 0.5% | 1.5% | 2.6% | |
| 下痢 | 3.1% | 0.4% | 1.8% | 2.7% | 2.7% | 2.6% | |
| 食欲不振 | 13.9% | 2.9% | 7.3% | 7.0% | 8.2% | 6.1% | 2.6% |
*1:「C型慢性活動性肝炎におけるウイルス血症の改善」の承認時
*2:「C型慢性活動性肝炎におけるウイルス血症の改善」の使用成績調査
*3:「C型慢性活動性肝炎におけるウイルス血症の改善」の承認時の指導事項による市販後臨床試験
*4:「C型慢性肝炎におけるウイルス血症の改善(血中HCV RNA量が高い場合を除く)」の承認時
*5:「小児C型慢性肝炎に対する用法・用量追加」の承認時
主な臨床検査値異常※
(出典:オーアイエフ(R)の医薬品インタビューフォーム2006年12月改訂版)
| B型慢性活動性肝炎 | C型慢性肝炎 | ||||||
| 承認時 | 使用成績 調査 |
CAH 承認時*1 |
CAH使用 成績調査*2 |
CAH市販後 臨床試験*3 |
CPH 承認時*4 |
小児C肝 承認時*5 |
|
| 白血球減少(症) | 42.7% | 24.4% | 27.6% | 29.7% | 59.3% | 25.8% | 5.4% |
| 血小板減少(症) | 36.4% | 22.4% | 25.3% | 35.7% | 55.6% | 22.7% | 5.6% |
| ヘモグロビン減少 | 0.3% | 0.4% | 1.6% | 4.0% | 4.6% | 5.2% | 0.0% |
| 赤血球減少 | 1.7% | 0.9% | 1.7% | 3.4% | 5.6% | 2.1% | 0.0% |
| 好中球減少 | 3.2% | 4.0% | 9.1% | 2.1% | 40.0% | 7.6% | 2.8% |
| AST(GOT)上昇 | 5.8% | 0.4% | 0.6% | 1.0% | 0.0% | 0.5% | 0.0% |
| ALT(GPT)上昇 | 5.8% | 0.6% | 0.6% | 1.2% | 0.9% | 0.5% | 0.0% |
| 蛋白尿 | 2.2% | 1.4% | 4.8% | 1.9% | 7.4% | 4.5% | 0.0% |
| コレステロール減少 | 2.5% | ||||||
*1:「C型慢性活動性肝炎におけるウイルス血症の改善」の承認時
*2:「C型慢性活動性肝炎におけるウイルス血症の改善」の使用成績調査
*3:「C型慢性活動性肝炎におけるウイルス血症の改善」の承認時の指導事項による市販後臨床試験
*4:「C型慢性肝炎におけるウイルス血症の改善(血中HCV RNA量が高い場合を除く)」の承認時
*5:「小児C型慢性肝炎に対する用法・用量追加」の承認時
※臨床検査値異常(除検査例数100例未満)の発現頻度は, 検査例数を分母, 臨床検査値異常の件数を分子として計算。
●インターフェロンアルファ-2b(遺伝子組換え)「イントロン(R)A」
本剤単独及びリバビリンと併用投与した際の副作用発現頻度は以下のとおり。
(出典:シェリング・プラウ(株)からの資料)
| 本剤単独(承認前+承認後*1) | ||
| C型慢性肝炎 | B型慢性活動性肝炎 | |
| 調査例数 | 5,554 | 1,084 |
| 副作用等の発現症例数 | 4,819 | 896 |
| 副作用等の発現症例率 | 86.8% | 82.7% |
| 主な副作用※ | ||
| 発熱 | 75.2% | 72.7% |
| 倦怠(感) | 14.5% | 11.9% |
| 頭痛 | 7.7% | 7.6% |
| 白血球減少(症) | 20.4% | 40.4% |
| 顆粒球減少(症) | 4.3% | 6.1% |
| 血小板減少(症) | 22.6% | 34.4% |
| 貧血 | 5.4% | 3.0% |
| AST(GOT)上昇 | 0.6% | 6.0% |
| ALT(GPT)上昇 | 0.6% | 6.3% |
| 食欲不振 | 12.6% | 10.9% |
| 脱毛 | 15.3% | 7.0% |
| 関節痛 | 5.0% | 4.8% |
*1:承認時までの調査及び再審査結果に基づく
※:C型慢性肝炎又はB型慢性活動性肝炎いずれかの集計において5%以上の発現が認められた副作用
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
*2:承認までの副作用の集計成績(本剤+リバビリン併用;24週間投与)
※※:自他覚症状を含む貧血のほか, 赤血球減少, ヘモグロビン減少, ヘマトクリット減少等の臨床検査値異常を含む。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
*3:国内臨床試験での副作用の集計成績(本剤+リバビリン併用;48週間投与)
●インターフェロンアルファコン-1(遺伝子組換え)「アドバフェロン(R)」
(出典:第8回安全性定期報告からの資料)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
*1:2002年10月~2007年9月までの特別調査(特定使用成績調査)の累計
●インターフェロンベータ「フエロン(R)」, 「IFNβモチダ」
「フエロン(R)」の承認前の国内臨床試験及び市販後調査等における主な副作用発現頻度は以下のとおり。
(出典:東レ(株)からの資料)
| C型慢性肝炎 | B型慢性活動性肝炎 | |
| 調査例数 | 2,573 | 1,392 |
| 副作用等の発現症例数 | 2,207 | 1,278 |
| 副作用等の発現症例率 | 85.78% | 91.81% |
| 主な副作用 | ||
| 発熱 | 72.87% | 90.59% |
| 倦怠感 | 6.53% | 1.72% |
| 全身倦怠感 | 19.08% | 18.75% |
| 頭痛・頭重感 | 26.43% | 20.47% |
| 頭部不快感 | 0.04% | ― |
| 血小板減少 | 26.12% | 7.26% |
| 白血球減少 | 22.08% | 9.84% |
| 好中球減少 | 9.25% | 0.29% |
| 顆粒球減少 | 1.17% | 0.86% |
| 血清アルブミン低下 | 8.67% | 0.14% |
| 低アルブミン血症 | 1.79% | 0.07% |
| 関節痛 | 15.12% | 8.05% |
| 悪心・嘔吐 | 6.18% | 4.53% |
| 嘔気 | 0.39% | 1.65% |
| 吐き気 | 0.08% | 0.14% |
| むかつき | 0.16% | ― |
| 食欲不振 | 12.55% | 14.08% |
| 食思不振 | 0.39% | ― |
| 食欲減退 | 0.12% | 0.07% |
| AST(GOT)上昇 | 5.29% | ― |
| 血清AST(GOT)上昇 | 0.43% | 0.72% |
| 一過性AST(GOT)上昇 | 0.04% | ― |
| ALT(GPT)上昇 | 5.17% | ― |
| 血清ALT(GPT)上昇 | 0.35% | 0.72% |
| 一過性ALT(GPT)上昇 | 0.04% | ― |
| 蛋白尿 | 24.87% | 1.08% |
| 尿蛋白増加 | 0.16% | ― |
| 尿蛋白陽性 | 0.51% | ― |
| 悪寒・戦慄 | 22.66% | 15.45% |
| さむけ | 0.04% | 0.22% |
| それぞれの調査期間は以下のとおり。 | |
| 「C型慢性肝炎」:1986年6月~2001年10月 「B型慢性活動性肝炎」:1980年6月~1992年12月 |
|
「IFNβモチダ」について, C型慢性活動性肝炎患者を対象とした調査における副作用発現頻度は以下のとおり。
(出典:持田製薬(株)からの資料)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
「使用成績調査」の調査期間:1994年3月4日~1996年3月26日
●ペグインターフェロンアルファ-2a(遺伝子組換え)「ペガシス(R)」
(出典:中外製薬(株)からの資料)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
*1:2007年7月時点での使用成績調査の累計
●ペグインターフェロンアルファ-2b(遺伝子組換え)「ペグイントロン(R)」
承認時までに実施された国内臨床試験の副作用発現頻度は以下のとおり(いずれもリバビリンとの併用)。
(出典:シェリング・プラウ(株)からの資料)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
非麦角系ドパミンアゴニストによる 突発的睡眠等について(自動車の運転等をさせないことの患者説明の徹底)
| 成分名 販売名(会社名) |
成分名 | 販売名(会社名) | |||||||||||
|
|
||||||||||||
| 薬効分類等 | 抗パーキンソン剤 | ||||||||||||
| 効 能 効 果 | パーキンソン病 | ||||||||||||
1.経緯
(1)塩酸プラミペキソール水和物, (2)塩酸ロピニロール及び(3)塩酸タリペキソールは, 非麦角系ドパミンアゴニストと呼ばれる抗パーキンソン剤であり, 「パーキンソン病」を効能・効果として, それぞれ, (1)平成16年1月, (2)平成18年12月及び(3)平成8年6月から販売が開始されている。
(3)塩酸タリペキソールについては, 販売開始時より使用上の注意の「一般的注意」の項に「眠気等がみられることがあるので, 自動車の運転等危険を伴う作業に従事させないよう注意する」旨を記載し, 医療関係者に注意喚起を行っていた。その後, 平成14年2月, 欧州医薬品庁(EMEA)の医薬品委員会(CPMP)が, ドパミンアゴニストによる突発的睡眠に関する調査報告(http://www.emea.europa.eu/pdfs/human/press/pos/057802.pdf)をとりまとめたことを踏まえ, 我が国においても平成15年3月に(3)塩酸タリペキソールの使用上の注意の「重大な副作用」の項に「突発的睡眠」を追記するとともに, 「重要な基本的注意」の項に「突発的睡眠等がみられることがあるので, 自動車の運転等危険を伴う作業に従事させないよう注意する」旨を追記し, 注意喚起を行ってきた。また, (1)塩酸プラミペキソール水和物及び(2)塩酸ロピニロールについては, 販売開始時より使用上の注意の「警告」の項に「本剤服用中には, 自動車の運転等危険を伴う作業に従事させないよう注意する」旨を記載するとともに, 「重要な基本的注意」の項に「患者には本剤の突発的睡眠及び傾眠等についてよく説明し, 自動車の運転等危険を伴う作業に従事させないよう注意すること」及び「重大な副作用」の項に「突発的睡眠等」を記載し, 医療関係者に注意喚起を行ってきたところである。
しかしながら, これらの非麦角系ドパミンアゴニスト服用中に自動車を運転し, 突発的睡眠等により自動車事故を起こした症例が報告されていることから, これらの服用中に自動車の運転, 機械の操作, 高所作業等危険を伴う作業に従事しないよう患者への説明を更に徹底するため, 関係企業に対し, 平成20年2月12日に使用上の注意の改訂指示等を行ったので, その安全対策について紹介する。
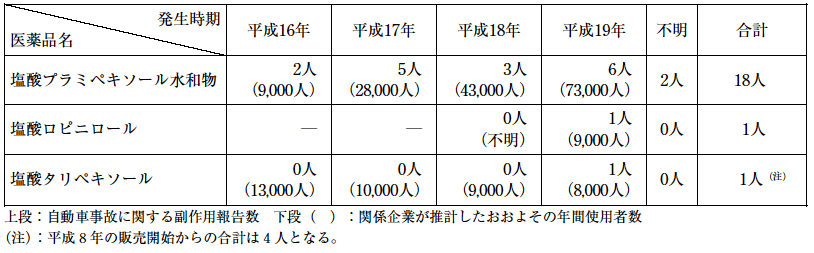
2.副作用の報告状況
平成16年以降の自動車事故に関する副作用報告を表1に示す。
(1)塩酸プラミペキソール水和物が合計で18人であり, (2)塩酸ロピニロールと(3)塩酸タリペキソールが各1人である。なお, (3)塩酸タリペキソールの1人は(1)塩酸プラミペキソール水和物との併用例である。
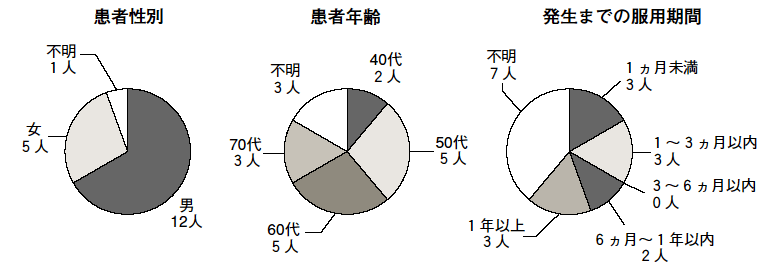
また, (1)塩酸プラミペキソール水和物における自動車事故に関する副作用報告18人の性別, 年齢別及び発生までの服用期間の内訳を図1に示す。
参考として報告された症例の一部を表2に紹介する。
3.安全対策
|
非麦角系ドパミンアゴニストの使用に際しては, 以下の事項に関する患者説明の徹底が重要である。
|
厚生労働省は平成20年2月12日, これらの薬剤の関係企業に対して, 「警告」又は「重要な基本的注意」の項を改訂し, 突発的睡眠等による自動車事故を起こした例が報告されている旨及び患者に突発的睡眠等についてよく説明する旨を追記するよう指示したところである。また, (1)塩酸プラミペキソール水和物については, 併せて, 速やかに「安全性情報」を作成し, 医療関係者に対する情報伝達の徹底を指示したところである。
医療関係者におかれては, 突発的睡眠等に伴う自動車事故については, 患者年齢, 性別, 発生までの服用期間, 発生時の服用量について特定の傾向は認められなかったことから, これらの薬剤服用中の患者に対し, 自動車の運転等に従事させないよう, 十分な説明をお願いする。
《使用上の注意(下線部追加改訂部分)》
(1)塩酸プラミペキソール水和物
| [警 告] |
|
|
| [重要な基本的注意] | 突発的睡眠等により自動車事故を起こした例が報告されている。突発的睡眠を起こした症例の中には, 傾眠や過度の眠気のような前兆を認めなかった例あるいは投与開始後1年以上経過した後に初めて発現した例も報告されている。患者には本剤の突発的睡眠及び傾眠等についてよく説明し, 自動車の運転, 機械の操作, 高所作業等危険を伴う作業に従事させないよう注意すること。 |
(2)塩酸ロピニロール
| [警 告] |
|
|
| [重要な基本的注意] | 突発的睡眠により自動車事故を起こした例が報告されていることから, 患者には突発的睡眠及び傾眠等についてよく説明し, 自動車の運転, 機械の操作, 高所作業等危険を伴う作業に従事させないよう注意すること。なお, 海外において突発的睡眠を起こした症例の中には, 傾眠や過度の眠気のような前兆を認めなかった例あるいは投与開始後1年以上経過した後に初めて発現した例も報告されている。 |
(3)塩酸タリペキソール
| [重要な基本的注意] | 前兆のない突発的睡眠, 傾眠, 注意力・集中力・反射機能等の低下, ふらつき, めまい及び起立性低血圧がみられることがあり, 突発的睡眠等により自動車事故を起こした例が報告されている。突発的睡眠を起こした症例の中には, 傾眠や過度の眠気のような前兆を認めなかった例が報告されている。患者には本剤の突発的睡眠及び傾眠等についてよく説明し, 自動車の運転, 機械の操作, 高所作業等危険を伴う作業に従事させないよう注意すること。 |
表2 症例の概要
(1)塩酸プラミペキソール水和物
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||
| 1 | 女 40代 |
パーキンソン病 (便秘) |
1.5mg 427日間 ↓ 2mg 28日間 ↓ 2.5mg 510日間 ↓ 3mg 57日間 ↓ 3.5mg 195日間 ↓ 4mg 28日間 ↓ 1.5mg 27日間 |
突発的睡眠(自動車事故, 下顎裂傷)
|
||||||||||||||||||
| 併用薬:レボドパ・カルビドパ, アマンタジン塩酸塩, ジアゼパム, 塩酸セレギリン, エンタカポン | ||||||||||||||||||||||
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||
| 2 | 男 70代 |
パーキンソン病(高血圧, 高脂血症, 便秘, 逆流性食道炎, 胃潰瘍) | 0.125mg 7日間 ↓ 0.5mg 7日間 ↓ 1mg 7日間 ↓ 1.5mg 7日間 ↓ 2mg 17日間 ↓ 2.5mg 7日間 ↓ 3mg 210日間 ↓ 1.5mg 56日間 ↓ 2mg 55日間 |
突発的睡眠(自動車事故)
|
||||
| 併用薬:フマル酸ビソプロロール, ニフェジピン, バルサルタン, アトルバスタチンカルシウム水和物, イコサペント酸エチル, 重質酸化マグネシウム, ラベプラゾールナトリウム | ||||||||
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||
| 3 | 男 60代 |
パーキンソン病 (便秘) |
0.25mg 投与継続 |
傾眠(自動車事故)
本剤投与開始前に眠気の訴えはなかった。
|
||||
| 併用薬:カベルゴリン, トリヘキシフェニジル塩酸塩, 酸化マグネシウム, レボドパ・カルビドパ | ||||||||
(2)塩酸ロピニロール
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||
| 4 | 男 50代 |
パーキンソン病 (高コレステロール血症) |
1.5mg 43日間 |
突発的睡眠(自動車事故)
|
||||||
| 併用薬:レボドパ・カルビドパ, 塩酸セレギリン, トリヘキシフェニジル塩酸塩, アトルバスタチンカルシウム水和物 | ||||||||||
(3)塩酸タリペキソール
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||
| 5 | 男 40代 |
パーキンソン病 (なし) |
0.8mg 50日間 ↓ 0.4mg 7日間 |
突発的睡眠(自動車事故)
|
||||||||||
| 併用薬:塩酸プラミペキソール水和物, エンタカポン, ゾニサミド, クロナゼパム, ペルゴリド, アマンタジン塩酸塩, レボドパ・カルビドパ | ||||||||||||||
重要な副作用等に関する情報
平成20年2月12日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について, 改訂内容等とともに改訂の根拠となった症例の概要等に関する情報を紹介いたします。
【1】シクロホスファミド(経口剤), シクロホスファミド(注射剤)
(1)シクロホスファミド(経口剤)| 販売名(会社名) | エンドキサン錠50mg(塩野義製薬) |
| 薬効分類等 | アルキル化剤 |
| 効 能 効 果 | 下記疾患の自覚的並びに他覚的症状の緩解 多発性骨髄腫, 悪性リンパ腫(ホジキン病, リンパ肉腫, 細網肉腫), 乳癌 急性白血病, 真性多血症, 肺癌, 神経腫瘍(神経芽腫, 網膜芽腫), 骨腫瘍 ただし, 下記の疾患については, 他の抗腫瘍剤と併用することが必要である。 慢性リンパ性白血病, 慢性骨髄性白血病, 咽頭癌, 胃癌, 膵癌, 肝癌, 結腸癌, 子宮頸癌, 子宮体癌, 卵巣癌, 睾丸腫瘍, 絨毛性疾患(絨毛癌, 破壊胞状奇胎, 胞状奇胎), 横紋筋肉腫, 悪性黒色腫 |
| 《使用上の注意(下線部追加改訂部分)》 | |
| [副作用 (重大な副作用)] |
肝機能障害, 黄疸:肝機能障害, 黄疸があらわれることがあるので, 肝機能検査を行うなど観察を十分に行い, 異常が認められた場合には, 投与を中止するなど適切な処置を行うこと。 急性腎不全:急性腎不全等の重篤な腎障害があらわれることがあるので, 腎機能検査を行うなど観察を十分に行い, 異常が認められた場合には, 投与を中止するなど適切な処置を行うこと。 |
(2)シクロホスファミド(注射剤)
| 販売名(会社名) | 注射用エンドキサン100mg, 注射用同500mg(塩野義製薬) |
| 薬効分類等 | アルキル化剤 |
| 効 能 効 果 | 1.下記疾患の自覚的並びに他覚的症状の緩解 多発性骨髄腫, 悪性リンパ腫(ホジキン病, リンパ肉腫, 細網肉腫), 肺癌, 乳癌 急性白血病, 真性多血症, 子宮頸癌, 子宮体癌, 卵巣癌, 神経腫瘍(神経芽腫, 網膜芽腫), 骨腫瘍 ただし, 下記の疾患については, 他の抗悪性腫瘍剤と併用することが必要である。 慢性リンパ性白血病, 慢性骨髄性白血病, 咽頭癌, 胃癌, 膵癌, 肝癌, 結腸癌, 睾丸腫瘍, 絨毛性疾患(絨毛癌, 破壊胞状奇胎, 胞状奇胎), 横紋筋肉腫, 悪性黒色腫 2.以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法 乳癌(手術可能例における術前, あるいは術後化学療法) 3.下記疾患における造血幹細胞移植の前治療 急性白血病, 慢性骨髄性白血病, 骨髄異形成症候群, 重症再生不良性貧血, 悪性リンパ腫, 遺伝性疾患(免疫不全, 先天性代謝障害及び先天性血液疾患:Fanconi貧血, Wiskott-Aldrich症候群, Hunter病等) |
| 《使用上の注意(下線部追加改訂部分)》 | ||||||
| [副作用 (重大な副作用)] |
肝機能障害, 黄疸:肝機能障害, 黄疸があらわれることがあるので, 肝機能検査を行うなど観察を十分に行い, 異常が認められた場合には, 投与を中止するなど適切な処置を行うこと。 急性腎不全:急性腎不全等の重篤な腎障害があらわれることがあるので, 腎機能検査を行うなど観察を十分に行い, 異常が認められた場合には, 投与を中止するなど適切な処置を行うこと。 心筋障害, 心不全, 心タンポナーデ, 心膜炎:心筋障害, 心不全, 心タンポナーデ, 心膜炎, 心嚢液貯留があらわれることがあるので, 観察を十分に行い, 異常が認められた場合には, 投与を中止するなど適切な処置を行うこと。特に本剤を高用量で投与する場合(造血幹細胞移植の前治療等)は, 十分に注意すること。 |
|||||
| 〈参 考〉 |
直近約3年間(平成16年4月1日~平成19年12月1日)の副作用報告(因果関係が否定できないもの)の件数
|
|||||
症例の概要
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||||
| 1 | 男 50代 |
末梢血幹細胞アフェレーシス (慢性腎不全, 前立腺肥大, 高血圧) |
3000mg 2日間 |
急性腎不全 既往歴:糖尿病
|
||||||||||||||||||||||
臨床検査値
|
||||||||||||||||||||||||||
| 併用薬:メスナ, 塩酸グラニセトロン, ベシル酸アムロジピン, ランソプラゾール, アセトアミノフェン | ||||||||||||||||||||||||||
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||||||||||||||
| 2 | 女 50代 |
骨髄移植前治療 (なし) |
2200mg 2日間 |
心タンポナーデ, 心嚢液貯留 既往歴:肝障害(塩酸セフォゾプラン)
|
||||||||||||||||||||||||||
| 併用薬:メスナ, アシクロビル | ||||||||||||||||||||||||||||||
| No. | 患者 | 1日投与量 投与期間 |
副作用 | |||||||||||||||
| 性・ 年齢 |
使用理由 (合併症) |
経過及び処置 | ||||||||||||||||
| 3 | 女 30代 |
骨髄移植前治療 (なし) |
2900mg 2日間 |
心膜炎 既往歴:なし
|
||||||||||||||
| 併用薬:なし | ||||||||||||||||||
使用上の注意の改訂について
(その195)
平成20年2月12日に改訂を指導した医薬品の使用上の注意(本号の「2非麦角系ドパミンアゴニストによる突発的睡眠等について(自動車の運転等をさせないことの患者説明の徹底)」, 「3重要な副作用等に関する情報」で紹介したものを除く。)について, 改訂内容, 主な該当販売名等をお知らせいたします。
| 1 | 〈血管拡張剤〉 ニコランジル(経口剤) |
|
| [販売名] | シグマート錠2.5mg, 同錠5mg(中外製薬)他 |
| [副作用 (重大な副作用)] |
口内潰瘍, 舌潰瘍, 肛門潰瘍, 消化管潰瘍:口内潰瘍, 舌潰瘍, 肛門潰瘍, 消化管潰瘍があらわれることがあるので, 症状があらわれた場合には投与を中止し, 適切な処置を行うこと。 |
| 2 | 〈合成抗菌剤〉 塩酸モキシフロキサシン(経口剤) |
|
| [販売名] | アベロックス錠400mg(バイエル薬品) |
| [副作用 (重大な副作用)] |
低血糖:重篤な低血糖があらわれることがある(高齢者, 糖尿病患者であらわれやすい)ので, 観察を十分に行い, 異常が認められた場合には投与を中止し, 適切な処置を行うこと。 |
市販直後調査の対象品目一覧
| (平成20年3月1日現在) |
| 一般名 | 製造販売業者名 | 市販直後調査開始年月日 |
| 販売名 | ||
| タダラフィル | 日本イーライリリー(株) | 平成19年9月12日 |
| シアリス錠5mg, 同錠10mg, 同錠20mg | ||
| トピラマート | 協和発酵工業(株) | 平成19年9月26日 |
| トピナ錠50mg, 同錠100mg | ||
| モンテルカストナトリウム | 杏林製薬(株) | 平成19年10月2日 |
| キプレス細粒4mg | ||
| モンテルカストナトリウム | 萬有製薬(株) | 平成19年10月2日 |
| シングレア細粒4mg | ||
| ロクロニウム臭化物 | 日本オルガノン(株) | 平成19年10月2日 |
| エスラックス静注25mg/2.5mL, 同静注50mg/5.0mL | ||
| メシル酸ガレノキサシン水和物 | 富山化学工業(株) | 平成19年10月5日 |
| ジェニナック錠200mg | ||
| イデュルスルファーゼ(遺伝子組換え) | ジェンザイム・ジャパン(株) | 平成19年10月17日 |
| エラプレース点滴静注液6mg | ||
| ピロカルピン塩酸塩 | キッセイ薬品工業(株) | 平成19年10月19日 |
| サラジェン錠5mg*1 | ||
| ニコランジル | 中外製薬(株) | 平成19年10月19日 |
| シグマート注2mg, 同注12mg, 同注48mg*2 | ||
| 硫酸クロピドグレル | サノフィ・アベンティス(株) | 平成19年10月19日 |
| プラビックス錠25mg, 同錠75mg*3 | ||
| ロラタジン | シェリング・プラウ(株) | 平成19年10月19日 |
| クラリチン錠10mg, 同レディタブ錠10mg*4 | ||
| トラボプロスト | 日本アルコン(株) | 平成19年10月25日 |
| トラバタンズ点眼液0.004% | ||
| 塩化ストロンチウム(89Sr) | 日本メジフィジックス(株) | 平成19年10月31日 |
| メタストロン注 | ||
| エプレレノン | ファイザー(株) | 平成19年11月13日 |
| セララ錠25mg, 同錠50mg, 同錠100mg | ||
| エストラジオール | (株)ポーラファルマ | 平成19年11月20日 |
| ディビゲル1mg | ||
| イミキモド | 持田製薬(株) | 平成19年12月10日 |
| ベセルナクリーム5% | ||
| ダルナビルエタノール付加物 | ヤンセンファーマ(株) | 平成19年12月10日 |
| プリジスタ錠300mg | ||
| インスリンデテミル(遺伝子組換え) | ノボノルディスクファーマ(株) | 平成19年12月14日 |
| レベミル注300, 同注300フレックスペン | ||
| ネララビン | グラクソ・スミスクライン(株) | 平成19年12月14日 |
| アラノンジー静注用250mg | ||
| エルロチニブ塩酸塩 | 中外製薬(株) | 平成19年12月18日 |
| タルセバ錠25mg, 同錠100mg, 同錠150mg | ||
| 塩酸メチルフェニデート | ヤンセンファーマ(株) | 平成19年12月19日 |
| コンサータ錠18mg, 同錠27mg | ||
| ベラプロストナトリウム | 東レ(株) | 平成19年12月19日 |
| ケアロードLA錠60μg | ||
| ベラプロストナトリウム | 科研製薬(株) | 平成19年12月19日 |
| ベラサスLA錠60μg | ||
| ジエノゲスト | 持田製薬(株) | 平成20年1月21日 |
| ディナゲスト錠1mg | ||
| ロラタジン | シェリング・プラウ(株) | 平成20年1月21日 |
| クラリチンドライシロップ1% | ||
| ガドキセト酸ナトリウム | バイエル薬品(株) | 平成20年1月25日 |
| EOB・プリモビスト注シリンジ | ||
| シナカルセト塩酸塩 | キリンファーマ(株) | 平成20年1月25日 |
| レグパラ錠25mg, 同錠75mg | ||
| モンテルカストナトリウム | 杏林製薬(株) | 平成20年1月25日 |
| キプレス錠10*5 | ||
| モンテルカストナトリウム | 萬有製薬(株) | 平成20年1月25日 |
| シングレア錠10*5 | ||
| ソラフェニブトシル酸塩 | バイエル薬品(株) | 平成20年2月25日 |
| ネクサバール錠200mg |
| *1: | 効能追加された「シェーグレン症候群患者の口腔乾燥症状の改善」 |
| *2: | 効能追加された「急性心不全(慢性心不全の急性増悪期を含む)」 |
| *3: | 効能追加された「経皮的冠動脈形成術(PCI)が適用される急性冠症候群(不安定狭心症, 非ST上昇心筋梗塞)」 |
| *4: | 用法追加された「小児」 |
| *5: | 効能追加された「アレルギー性鼻炎」 |
|
