
第1回
日時:2024年1月22日(月曜日)16時から18時まで
場所:TKP新橋カンファレンスセンター13階Bルーム(ハイブリッド会議)
第2回
日時:2024年3月5日(火曜日)17時から19時まで
場所:TKP新橋カンファレンスセンター13階Bルーム(ハイブリッド会議)





医薬品の製造販売業者や規制当局等による医療情報データベースを活用した調査の事例を収集・共有するとともに、製薬企業に対して実施されたアンケート結果等に基づき、医薬品安全性監視における医療情報データベース活用における課題等について整理する。

第1回 2024年1月22日
| 内容 | 発表者 | 時間 | |
|---|---|---|---|
| はじめに | あいさつ | 厚生労働省 | 5分 |
| コンソーシアムの目的と参加者の紹介 | IQVIA | 5分 | |
| 発表 | 事務連絡およびDB活用事例の紹介[1.38MB] | 医薬品医療機器総合機構 | 20分 |
| 事例調査結果の共有[370KB] | IQVIA | 20分 | |
| アンケート結果の共有[974KB] | 製薬企業 | 20分 | |
| 質疑応答と討論 | 安全性監視活動におけるRWDの活用について | 全員 | 40分 |
| さいごに | 本日のまとめ (第2回に向けて) | 厚生労働省 | 10分 |
第2回 2024年3月5日
| 内容 | 発表者 | 時間 | |
|---|---|---|---|
| はじめに | あいさつ | 厚生労働省 | 5分 |
| 第1回の討論の振り返り | IQVIA | 5分 | |
| 総合討論 | 医薬品安全性監視におけるRWD活用の課題と対策 | 全員 | 100分 |
| さいごに | 今後の進め方 | IQVIA | 5分 |
| 今年度のまとめ | 厚生労働省 | 5分 | |

- 医薬品安全性監視におけるRWD活用の課題と対策について、「医薬品安全性監視の将来像」「医薬品安全性監視の役割分担」「海外事例と日本事例の差異」「製薬企業アンケートからの課題と要望」の視点で討議し、その討議内容を医薬品安全性監視活動におけるRWD活用のプロセスに添って5つの視点で整理した。
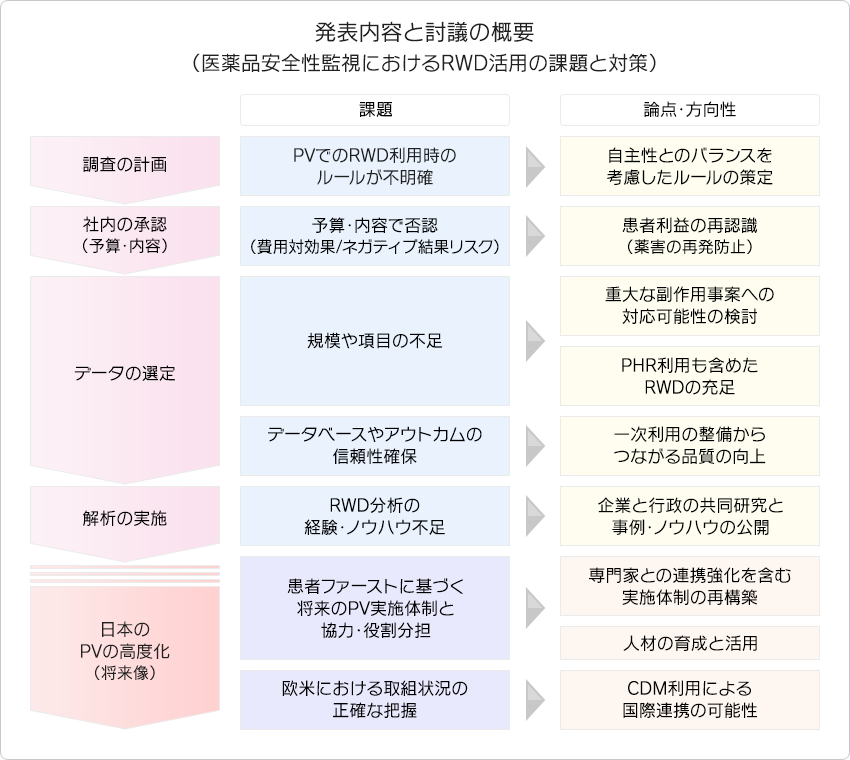

 令和5年度医療情報DB 推進コンソーシアム報告書(概要)[206KB]
令和5年度医療情報DB 推進コンソーシアム報告書(概要)[206KB]
 令和5年度医療情報DB 推進コンソーシアム報告書(詳細)[1.52MB]
令和5年度医療情報DB 推進コンソーシアム報告書(詳細)[1.52MB]
 令和5年度医療情報DB 推進コンソーシアム(第1回)議事概要[330KB]
令和5年度医療情報DB 推進コンソーシアム(第1回)議事概要[330KB]
 令和5年度医療情報DB 推進コンソーシアム(第2回)議事概要[276KB]
令和5年度医療情報DB 推進コンソーシアム(第2回)議事概要[276KB]
