目次
- 医療事故防止等のための医療用医薬品へのバーコード表示の実施について
- 市販直後安全性情報収集事業(定点観測事業)について
- 使用上の注意の改訂について(その180)
8歳未満の小児に対する適用を取得していない自動体外式除細動器(AED) - 市販直後調査の対象品目一覧
(参考資料)
インフルエンザに伴う随伴症状の発現状況に関する調査研究について
この医薬品・医療機器等安全性情報は, 厚生労働省において収集された副作用等の情報をもとに, 医薬品・医療機器等のより安全な使用に役立てていただくために, 医療関係者に対して情報提供されるものです。
平成18年(2006年)10月
厚生労働省医薬食品局
| No. | 医薬品等 | 対策 | 情報の概要 | ||||
|---|---|---|---|---|---|---|---|
| 1 | 医療事故防止等のための医療用医薬品へのバーコード表示の実施について | 医薬品の取り違え事故の防止及びトレーサビリティの確保を推進するため, 医療用医薬品へのバーコード表示の実施要項を通知したので, その作成に至った経緯, 概要, 実施時期等について紹介する。 通知された「新バーコード表示」においては, 医療用医薬品の使用単位毎(アンプル1本単位等)に製品を特定するバーコードを表示して, それを機械的に読み取るようにすることにより,
|
|||||
| 2 | 市販直後安全性情報収集事業(定点観測事業)について | 医薬品等の市販後安全対策については, 医療現場で発生した副作用等の情報をいかに迅速かつ正確に収集するかが重要であり, 薬事法において, 製造販売業者等及び医療関係者からの副作用報告制度が設けられているが, 情報収集の複線化の観点から, 平成18年度から市販直後安全性情報収集事業を実施しているので紹介する。 | |||||
| 3 | 8歳未満の小児に対する適用を取得していない自動体外式除細動器(AED) | 使用上の注意の改訂について(その180) | |||||
| 4 | 市販直後調査対象品目 | 平成18年10月1日現在, 市販直後調査の対象品目一覧を紹介する。 |
(緊):緊急安全性情報の配布 (使):使用上の注意の改訂 (症):症例の紹介
|
厚生労働大臣への副作用等報告は, 医療関係者の業務です。 医師, 歯科医師, 薬剤師等の医療関係者は, 医薬品や医療機器による副作用, 感染症, 不具合を知ったときは, 直接又は当該医薬品等の製造販売業者を通じて厚生労働大臣へ報告してください。なお, 薬種商販売業や配置販売業の従事者も医療関係者として, 副作用等につき, 報告することが求められています。 |
医療事故防止等のための医療用医薬品へのバーコード表示の実施について
1.はじめに
医療事故防止等のための医療用医薬品へのバーコード表示の実施について, 平成18年9月15日付薬食安発第0915001号厚生労働省医薬食品局安全対策課長通知「医療用医薬品へのバーコード表示の実施について」により, 医療用医薬品へのバーコード表示の実施要項を示し, 製造販売業者に対して適正にバーコード表示を行うよう求めたので, その作成に至った経緯, 概要, 実施時期等について紹介する。
2.経緯
これまで医薬品の名称や外観の類似性に係る医療事故防止対策の厚生労働省としての取組については, 具体的な検討の場として, 平成12年5月に「医薬品・医療用具等関連医療事故防止対策検討会」を設置し, その後, 平成13年5月以降は「医療安全対策検討会議 医薬品・医療用具等対策部会」及びその下に設置された「医薬品類似性ワーキンググループ」において具体的な対策の検討を行ってきた。
これらの会議での検討結果を踏まえ, これまで以下の通知を発出してきた。
| (1) | 平成12年9月19日付医薬発第935号厚生省医薬安全局長通知 「医療事故を防止するための医薬品の表示事項及び販売名の取扱いについて」 |
| (2) | 平成15年11月27日付薬食発第1127003号厚生労働省医薬食品局長通知 「医薬品の販売名・外観の類似性による医療事故防止対策の徹底について」 |
| (3) | 平成16年6月2日付薬食発第0602009号厚生労働省医薬食品局長通知 「医薬品関連医療事故防止対策の強化・徹底について」 等 |
これらの通知により, 誤用を招きやすい剤型をした医薬品に係る注意表示の改善, PTPシート等の内袋への表示事項の標準化(販売名, 規格・含量等の明記等), 医療用医薬品の販売名のルール化等について, 関係企業における積極的な取組を指導しているところである。また, これらの情報については, 「医薬品・医療用具等安全性情報」No.163(平成12年11月), 同No.202(平成16年6月)等に掲載して紹介してきたところである。
一方, 医薬品の取り違え等を防止するためには, 以上のような表示等の改善による対策に加えて, 目視による確認以外の方法による処方チェックなどの抜本的な対策の必要性が指摘されてきた。まず, 平成14年4月の有識者からなる「医療安全対策検討会議」が取りまとめた「医療安全推進総合対策」において, バーコードチェックの利用により, 製品の区別は正確かつ容易に行いうるため, 国が実施すべき課題としてバーコードチェックがさらに普及するよう, 医薬品コード表示の標準化が提言された。その後, 平成15年12月, 厚生労働大臣「医療事故対策緊急アピール」で, 医薬品等の「もの」に対する対策として, 二次元コードやICタグを使った医薬品の管理など使用に際する安全管理の徹底を図ることが求められた。これらを踏まえて, 厚生労働省としては思い込みや人の目で確認するだけでなく, 機械で処方情報と照合することにより医薬品の取り違えによる医療事故を防止するために医薬品へのコード表示の標準化を推進することとした。そのため, 平成16年5月から, コード表示標準化検討会を設置してコード体系等を検討し, 同検討会が平成17年9月に報告した製品特定のためのコード体系(JANコードに基づくコード体系)に基づき「医療用医薬品へのバーコード表示の実施要項(案)」を取りまとめた。
これを受け, 平成18年3月24日から6月15日まで, 「医療用医薬品へのバーコード表示の実施要項(案)」についてパブリックコメントの募集を行い, 寄せられた意見やこれまでの検討を踏まえ, 平成18年9月15日付薬食安発第0915001号厚生労働省医薬食品局安全対策課長通知「医療用医薬品へのバーコード表示の実施について」により実施要項を示したところである。
3.医療用医薬品へのバーコード表示の概要
(1)目的
医療用医薬品の使用単位毎(アンプル1本単位等)に製品を特定するバーコードを表示して, それを機械的に読み取るようにすることにより,
| ・ | 機械的に製品を識別し, 取り違えによる医療事故の防止を図る。 |
| ・ | 製造・流通から患者への使用までの流れを記録することにより, トレーサビリティを確保する。 |
(2)表示対象及び表示するデータ
表示対象は医療用医薬品とし, 次の5つの種類に分けた。
| (1) | 特定生物由来製品 |
| (2) | 生物由来製品(特定生物由来製品を除く。) |
| (3) | 内用薬((1)及び(2)を除く。) |
| (4) | 注射薬((1)及び(2)を除く。) |
| (5) | 外用薬((1)及び(2)を除く。) |
包装形態の単位を次の3つに分け医療用医薬品の種類に応じ, 商品コード, 有効期限, 製造番号又は製造記号及び数量を表示する。
| ・調剤包装単位 | |
| 調剤包装単位とは, 製造販売業者が製造販売する医薬品を包装する最小の包装単位をいう。 例えば, 錠剤やカプセル剤であればPTPシートやバラ包装の瓶, 注射薬であればアンプルやバイアル等のことをいう。 |
|
| ・販売包装単位 | |
| 販売包装単位とは, 通常, 卸売販売業者等から医療機関等に販売される最小の包装単位をいう。 例えば, 錠剤やカプセル剤であれば調剤包装単位であるPTPシートが100シート入りの箱, 注射薬であれば10アンプル入りの箱等のことをいう。 |
|
| ・元梱包装単位 | |
| 元梱包装単位とは, 通常, 製造販売業者で販売包装単位を複数梱包した包装単位をいう。 例えば, 販売包装単位である箱が10箱入った段ボール箱等のことをいう。 |
|
| * | 「◎印は必ず表示するもの(必須表示)」, 「○印は必ずしも表示しなくて差し支えないもの(任意表示)」を示す。 |
| 医療用医薬品の種類 | 調剤包装単位 | 販売包装単位 | 元梱包装単位 | |||||||
| 商品 コード |
有効 期限 |
製造 番号 |
商品 コード |
有効 期限 |
製造 番号 |
商品 コード |
有効 期限 |
製造 番号 |
数量 | |
| (1)特定生物由来製品 | ◎ | ◎ | ◎ | ◎ | ◎ | ◎ | ◎ | ◎ | ◎ | ◎ |
| (2)生物由来製品(注1) | ◎ | ○ | ○ | ◎ | ◎ | ◎ | ◎ | ◎ | ◎ | ◎ |
| (3)内用薬(注2) | ◎ | ○ | ○ | ◎ | ○ | ○ | ○ | ○ | ○ | ○ |
| (4)注射薬(注2) | ◎ | ○ | ○ | ◎ | ○ | ○ | ○ | ○ | ○ | ○ |
| (5)外用薬(注2) | ◎ | ○ | ○ | ◎ | ○ | ○ | ○ | ○ | ○ | ○ |
| (注1) | 特定生物由来製品を除く。 |
| (注2) | 生物由来製品(特定生物由来製品を含む)を除く。 |
(3)商品コード及びJANコードの付番
| 1) | 商品コードは, 個々の医薬品の包装単位の種類ごとに付されるJANコードの先頭に, 調剤包装単位においては「0」, 販売包装単位においては「1」, 元梱包装単位においては「2」を付けた14桁のコードとする。 | |
| 2) | JANコードの付番方法 | |
| ・ | JANコードは個々の医薬品の包装単位の種類ごとに付すこと。例えば, 医療現場において, 10錠入りPTPシートと21錠入りPTPシートの両者間での取り違えを防止する必要があることなどから, 調剤包装では, 10錠のPTPシートと21錠のPTPシートは別の種類として取り扱うものとしています。 | |
| ・ | 元梱包装にあっては販売包装と同一のJANコードとすること。したがって, 調剤包装のJANコードは販売包装のJANコードとは別のJANコードとなるものであること。 | |
| ・ | JANコードは販売を行う会社ごとに付番すること。 | |
| ・ | 過去に使用したJANコードは, 当該JANコードを使用していた医薬品が販売中止されてから少なくとも10年経過してからでなければ, 再使用してはならない。ただし, 特定生物由来製品に使用したJANコードは, 再使用してはならない。 |
(4)名称, 成分の変更等に伴うJANコード変更のルールの策定
(5)バーコードシンボル体系とデータ要素の表記順及びアプリケーション識別子
1)調剤包装及び販売包装
| 商品コードに加え製造番号又は製造記号及び有効期限を表示する場合は, RSSリミテッド合成シンボルCC-Aを用いる。表示面積が小さい場合は, RSS-14スタック合成シンボルCC-Aを用いることができる。 商品コードのみを表示する場合は, RSSリミテッドを用いる。表示面積が小さい場合は, RSS-14スタックを用いることができる。 |
RSSコードの表示例
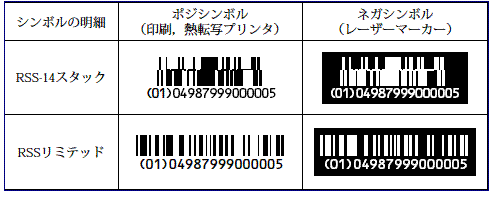
2)元梱包装
コード128を用いる。
コード128の表示例

(6)新バーコード表示の実施時期
| 1) | 特定生物由来製品, 生物由来製品若しくは注射薬(生物由来製品を除く。)のすべての包装単位又は内用薬(生物由来製品を除く。)若しくは外用薬(生物由来製品を除く。)の販売包装単位:平成20年9月(ただし, 年1回しか製造していないもの等特段の事情があるものについては平成21年9月)以降に製造販売業者から出荷されるものについてはすべて表示する。 | |
| 2) | 内用薬(生物由来製品を除く。)又は外用薬(生物由来製品を除く。)の調剤包装単位:関係業界等によって3~5年後の表示実施を目標に包装形態ごとの技術開発等が行われていることから, その実施時期については別途通知する。 |
(7)その他
| 1) | 現在, 販売包装単位に日本工業規格X0501(共通商品コード用バーコードシンボル)により表示されているバーコード及び元梱包装単位に日本工業規格X0502(物流商品コード用バーコードシンボル)により表示されているバーコードは, 医療用医薬品の販売包装単位及び元梱包装単位への新バーコード表示後少なくとも5年間は, 新バーコード表示と併記する。 | |
| 2) | バーコードで表示される情報のうち医薬品を特定する商品コードについては, 医療機関等において円滑に利用されるようその管理運用が一元的に行われることが望ましい。そのため, 各製品の販売業者がこれら商品コードを財団法人医療情報システム開発センターに登録し, 同センターが商品コードを管理し, そのデータを医療機関等に提供することとした。 | |
| 3) | 必ずしも表示しなくて差し支えないもの(任意表示)とされているデータについては, 今後の表示状況及び利用状況を踏まえ, その後の表示範囲の拡大について検討することとする。 |
4.おわりに
今般, バーコード表示に用いるコード, 表示するデータ内容及び実施時期等を「医療用医薬品へのバーコード表示の実施要項」として取りまとめた。この要項に沿ったバーコード表示が実施され, 医療用医薬品の商品コード等の情報のバーコード表示を利用することにより, 医薬品の取り違えによる医療事故の防止や, 生物由来製品の製造番号や有効期限の確認がより確実にできる環境が整うことなどが期待される。さらに, 医療機関では, 薬剤部における入荷検品・棚卸作業の効率化, 及び院内物流における適正在庫の確保が期待されるとともに, 処方情報と医薬品を照合することにより, 薬剤の払出し監査の効率化及び精度向上が期待される。
バーコードシステムの普及・実用化へ向けて, 医療機関においてバーコードチェックの利用について広く御理解, 御協力をいただけるようお願いしたい。
〈関係URL〉
| ・ | 「医薬品類似性ワーキンググループ」の検討結果について (厚生労働省ホームページ) http://www.mhlw.go.jp/shingi/2004/03/s0302-8.html |
| ・ | 「医療用医薬品へのバーコード表示の実施について」(平成18年9月15日付薬食安発第0915001号) (医薬品医療機器情報提供ホームページ) |
| ・ | パブリックコメント「医療用医薬品へのバーコード表示の実施について」に寄せられた御意見について http://search.e-gov.go.jp/servlet/Public?ANKEN_TYPE=3&OBJCD=100495 |
市販直後安全性情報収集事業(定点観測事業)について
1.はじめに
医薬品等の市販後安全対策については, 医療現場で発生した副作用等の情報をいかに迅速かつ正確に収集するかが重要であり, 薬事法において, 製造販売業者等及び医療関係者からの副作用報告制度が設けられている(薬事法第77条の4の2)。
さらに, 情報収集の複線化の観点から, 平成18年度から市販直後安全性情報収集事業を実施している。
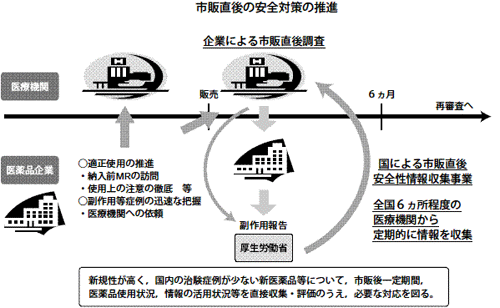
本事業は, 新たに承認される医薬品のうち, 新規性が高いものや国内外における使用経験が少ないもの等について, 特に市販直後の安全性確保が必要と判断されることから, 原則として市販後6ヵ月間は, 使用状況や副作用等の発現状況等, 臨床現場の情報を国が直接収集・評価するものであり, 安全対策の充実・強化を図ることを目的としている。
2.対象医薬品の選定について
本事業の対象となる医薬品(以下「対象医薬品」という。)は, 新たに承認される医薬品のうち, 原則として, 以下のいずれかに該当するものであって, 市販直後の安全性確保に特に留意が必要と判断されるものである。
| (1) | 新規性が高い注1)と判断されるもの | |
| (2) | 承認条件として全症例に係る使用成績調査を行うこととされたもの(希少疾病用医薬品を除く。) | |
| (3) | 国内外における使用経験が少ないもの注2) |
| 注1) | これまでに国内において, 類似の化学構造, 薬理作用等を有する医薬品が承認されていないもの等が新規性の高いものと考えられる。 | |
| 注2) | 例えば, 国内治験症例数が少ないもの(概ね50症例未満), 欧米の主要国において未発売のものなど。 |
対象医薬品は, 薬事・食品衛生審議会医薬品等安全対策部会の委員の意見を聴いて決定することとし, 選定の結果については, 本事業が, 対象医薬品の製造販売業者等が行う市販直後調査とは別に行われるものであることなどから, 終了時まで非公表とすることとしている。
3.担当医等の選定について
本事業は, 全国6ヵ所程度の医療機関の医師及び薬剤師(同医療機関の処方せんを応需している薬局等を含む。)に協力をお願いする。
協力をお願いする医師及び薬剤師は, 薬事・食品衛生審議会医薬品等安全対策部会の委員の意見を参考として, 治験参加医療機関, 対象医薬品の使用が相当数想定される医療機関から専門分野における高度の知識経験を有する者を選定することとし, その際には, 地域的なバランス, 所属する医療機関の規模, 設置主体等に配慮することとしている。
なお, 選定結果については, 対象品目と同様, 終了時まで非公表とすることとしている。
4.事業の流れ
本事業については, 原則として, 対象医薬品の市販後6ヵ月間実施することとし, 各医療機関の医師及び薬剤師から, 定期的に以下に掲げる情報について報告をいただき, 必要に応じて, 安全確保措置を講ずることとしている。
| ・ | 対象医薬品の使用状況及び副作用等の発現状況 |
| ・ | 製造販売業者等による対象医薬品に関する情報提供活動の状況 |
| ・ | 各医療機関内における安全管理情報の活用状況 |
| ・ | その他対象医薬品に関連する情報 |
また, 本事業の終了後には, その概要を直近の薬事・食品衛生審議会医薬品等安全対策部会に報告することとしている。
5.おわりに
医薬品等の安全対策については, 従来の製薬企業等を通じた安全対策に加えて, 今後は本事業を行うことにより, 安全対策の充実・強化に努めていきたいと考えている。
また, 本事業の担当医等に選定された場合は, 積極的な御協力をお願いしたい。
使用上の注意の改訂について(その180)
医療機器
前号(医薬品・医療機器等安全性情報No.228)以降に改訂を指導した医療機器の使用上の注意について, 改訂内容等をお知らせいたします。
| 1 | 8歳未満の小児に対する適用を取得していない自動体外式除細動器(AED)※ |
| ※当該医療機器の小児への適用に関して, 承認事項において禁忌・禁止とされている場合を除く。 |
| [小児等への 適用] |
|
||||||
| 〈参考〉 |
|
市販直後調査の対象品目一覧
| (平成18年10月1日現在) |
| 一般名 | 製造販売業者名 | 市販直後調査開始年月日 |
| 販売名 | ||
| インターフェロンベータ | 東レ(株) | 平成18年4月20日 |
| フエロン*1 | ||
| エポエチンベータ(遺伝子組換え) | 中外製薬(株) | 平成18年4月20日 |
| エポジン注アンプル750, 同注アンプル1500, 同注アンプル3000, 同注シリンジ750, 同注シリンジ1500, 同注シリンジ3000*2 | ||
| ソマトロピン(遺伝子組換え) | 日本イーライリリー(株) | 平成18年4月20日 |
| ヒューマトロープC6mg, 同C12mg*3 | ||
| ゾレドロン酸水和物 | ノバルティスファーマ(株) | 平成18年4月20日 |
| ゾメタ注射液4mg*4 | ||
| ミカファンギンナトリウム | アステラス製薬(株) | 平成18年4月20日 |
| ファンガード点滴用50mg, 同点滴用75mg*5 | ||
| リネゾリド | ファイザー(株) | 平成18年4月20日 |
| ザイボックス錠600mg, 同注射液600mg*6 | ||
| トシル酸トスフロキサシン | (株)ニデック | 平成18年4月28日 |
| トスフロ点眼液0.3% | ||
| 硫酸クロピドグレル | サノフィ・アベンティス(株) | 平成18年5月8日 |
| プラビックス錠25mg, 同錠75mg | ||
| シロドシン | キッセイ薬品工業(株) | 平成18年5月11日 |
| ユリーフカプセル2mg, 同カプセル4mg | ||
| トシル酸トスフロキサシン | 富山化学工業(株) | 平成18年5月11日 |
| オゼックス点眼液0.3% | ||
| ホリトロピンアルファ(遺伝子組換え) | セローノ・ジャパン(株) | 平成18年5月11日 |
| ゴナールエフ皮下注用75, 同皮下注用150 | ||
| レトロゾール | ノバルティスファーマ(株) | 平成18年5月11日 |
| フェマーラ錠2.5mg | ||
| ロキソプロフェンナトリウム | リードケミカル(株) | 平成18年5月23日 |
| ロキソニンパップ100mg | ||
| アリピプラゾール | 大塚製薬(株) | 平成18年6月8日 |
| エビリファイ錠3mg, 同錠6mg, 同散1% | ||
| コハク酸ソリフェナシン | アステラス製薬(株) | 平成18年6月8日 |
| ベシケア錠2.5mg, 同錠5mg | ||
| 酒石酸トルテロジン | ファイザー(株) | 平成18年6月8日 |
| デトルシトールカプセル2mg, 同カプセル4mg | ||
| アムホテリシンB | 大日本住友製薬(株) | 平成18年6月20日 |
| アムビゾーム点滴静注用50mg | ||
| 硫酸マグネシウム・ブドウ糖 | 東亜薬品工業(株) | 平成18年6月20日 |
| マグセント注100mL | ||
| 塩酸セルトラリン | ファイザー(株) | 平成18年7月7日 |
| ジェイゾロフト錠25mg, 同錠50mg | ||
| ソマトロピン(遺伝子組換え) | ファイザー(株) | 平成18年7月26日 |
| ジェノトロピン5.3mg, 同注射用12mg, 同ミニクイック皮下注用0.6mg, 同ミニクイック皮下注用1.0mg, 同ミニクイック皮下注用1.4mg*7 | ||
| イヌリン | (株)富士薬品 | 平成18年8月22日 |
| イヌリード注 | ||
| アレンドロン酸ナトリウム水和物 | 萬有製薬(株) | 平成18年9月15日 |
| フォサマック錠35mg | ||
| アレンドロン酸ナトリウム水和物 | 帝人ファーマ(株) | 平成18年9月15日 |
| ボナロン錠35mg | ||
| イトラコナゾール | ヤンセンファーマ(株) | 平成18年9月15日 |
| イトリゾール内用液1% | ||
| テモゾロミド | シェリング・プラウ(株) | 平成18年9月15日 |
| テモダールカプセル20mg, 同カプセル100mg | ||
| ブデソニド | アストラゼネカ(株) | 平成18年9月15日 |
| パルミコート吸入液0.25mg, 同液0.5mg | ||
| エンテカビル水和物 | ブリストル製薬(有) | 平成18年9月21日 |
| バラクルード錠0.5mg | ||
| 酢酸セトロレリクス | 日本化薬(株) | 平成18年9月21日 |
| セトロタイド注射用0.25mg, 同注射用3mg | ||
| 塩化マンガン四水和物 | 明治乳業(株) | 平成18年9月25日 |
| ボースデル内用液10 | ||
| ガバペンチン | ファイザー(株) | 平成18年9月25日 |
| ガバペン錠200mg, 同錠300mg, 同錠400mg |
注)効能追加等における対象
| *1: | 効能追加された「C型代償性肝硬変におけるウイルス血症の改善(HCVセログループ1の血中HCV-RNA量が高い場合を除く)」 |
| *2: | 効能追加された「未熟児貧血」 |
| *3: | 効能追加された「成人成長ホルモン分泌不全症(重症に限る)」 |
| *4: | 効能追加された「多発性骨髄腫による骨病変及び固形癌骨転移による骨病変」 |
| *5: | 用法追加された「小児」 |
| *6: | 効能追加された「〈適応菌種〉本剤に感性のメチシリン耐性黄色ブドウ球菌(MRSA)〈適応症〉敗血症, 深在性皮膚感染症, 慢性膿皮症, 外傷・熱傷及び手術創等の二次感染, 肺炎」 |
| *7: | 効能追加された「成人成長ホルモン分泌不全症(重症に限る)」 |
参考資料
インフルエンザに伴う随伴症状の発現状況に関する調査研究について
平成17年度の厚生労働科学研究として、作成が進められた「インフルエンザに伴う随伴症状の発現状況に関する調査研究」がまとまりましたので紹介します。
なお、本報告書については、資料1~4を含め、厚生労働省のホームページ(http://www.mhlw.go.jp/)に掲載しています。
厚生労働科学研究費補助金
年度総括研究報告書
「インフルエンザに伴う随伴症状の発現状況に関する調査研究」
(主任研究者)横田俊平
(横浜市立大学大学院医学研究科発生成育小児医療学教授)
| 研究内容の要旨 インフルエンザは種々の随伴症状を伴う疾患で、わが国では乳幼児に脳症を発症することが大きな問題になっている。このような乳幼児では発熱後けいれん、意識障害に至る間に特有の異常行動・言動が認められていたが、インフルエンザ脳症の前駆症状か、それともインフルエンザの一般的な随伴症状であるのか、あるいは治療に使用した薬剤の影響が拘わっているのかなど、不明な点も多い。そこで全国12都県の小児科医師に対して「医師用調査票」と「患者・家族用調査票」を用意し、インフルエンザ経過中に生じた臨床症状、使用した薬剤、それぞれの経過などについて記載を依頼し調査票の集計後統計学的解析を行った。随伴症状の発現時期は発熱第1~2病日に92%が集中しており、薬剤使用もアセトアミノフェンは第1~2病日に95.4%、タミフルは91.8%を使用していた。薬剤使用状況と臨床症状との関連性について検討したところ、タミフルと異常言動との関連性はタミフル未使用での発現頻度は10.6%であったのに対し、タミフル使用では11.9%と有意差を認めなかった。なお、同じ期間に異常言動発現とタミフル使用があった場合に、異常言動発現前にタミフルを使用した と仮定した場合のハザード比は1.16で、p値0.259で有意差はなく、一方、異常言動発現後にタミフル使用したと仮定した場合のハザード比は0.90であり、p値0.463でやはり有意差は認められなかった。肺炎合併についてみると、タミフル未使用の累積発生率は3.1%、タミフル使用では0.7%であり、また肺炎はタミフル使用前に併発したと仮定した場合のハザード比0.24(p値<0.0001)、使用後に併発したと仮定した場合には0.20(p値<0.0001)で、いずれの場合でもタミフルは肺炎を抑制していた。次シーズンにおいて随伴症状と薬剤使用との時間的関係をより詳細に検討する調査が必要である。 |
| 分担研究者: 森 雅亮(横浜市立大学大学院医学研究科発生成育小児医療学小児科)、森島恒雄(岡山大学大学院医歯薬学総合研究科小児医科学)、根津敦夫(横浜市立大学市民医療センター小児科)、奥村彰久(名古屋大学小児科〔現、順天堂大学小児科〕)、細谷光亮(福島県立大学小児科)、鈴木 宏(新潟大学国際感染症学)、藤田利治(統計数理研究所) |
A.研究の背景と目的
| インフルエンザは各種の随伴症状を伴う疾患で、とくにわが国では乳幼児にインフルエンザ脳症を発症することが大きな問題になっている。これまでの厚生労働省研究班および家族会の調査では、インフルエンザ脳症を発症した乳幼児では発熱後けいれん・意識障害に至る間に特有の異常行動・言動が認められていた。しかしこの異常行動・言動がインフルエンザ脳症の前駆症状として捉えられるものか、それともインフルエンザの一般的な随伴症状と考えられるものか不明の点も多く、インフルエンザそのものとの関連性を探ることが重要になっていた。他方、鳥インフルエンザの変異がすすみ、ヒトへの感染が危惧される時代ともなり、この意味からも現在流行を起こしているインフルエンザの一般症状、随伴症状の疫学所見を詰めておく必要性も生じてきた。さらには迅速診断法が進歩し、インフルエンザの診断が確定した患者様には抗インフルエンザ薬を処方するというインフルエンザの診療様式はほぼ確立した感があるが、処方の実態やインフルエンザの一般症状、随伴症状の経過との関連についての調査は必ずしも十分にはなされていないのが現状である。 以上の問題を勘案し、今回インフルエンザに伴う随伴症状の調査、処方の実態調査を実施した。 |
B.研究方法
- 調査方法
● 全国12都県の小児科医師に対して「医師用調査票」(資料1)と「患者・家族用調査票」(資料2)を用意し、インフルエンザ経過中に生じた臨床症状、使用した薬剤、それぞれの経過などについて記載を依頼し調査票の集計後統計学的解析を行った。 ● 依頼する医師に、まず調査開始日を決めてもらい、その日より迅速診断などの方法によりインフルエンザの診断が確定した患者すべてについて、連続10名に<患者・家族用調査票>を渡し記載して戴くよう取りはかっていただいた。 ● 同時に、該当する患者について医師側には<医師用調査票>の用意戴き、記載をお願いした。患者には、第7病日以降に調査票持参の上再診して戴き、先生方の方で調査票をお受け取り願った。再診ができない患者については電話などで情報聴取をお願いした。 ● <患者・家族用調査票>は再診の折に家族に持参させ、先生方に記載して戴いた<医師用調査票>と通し番号を合わせて、10名分をまとめて班員へ送付いただいた。 ● 本研究は、主任研究員が所属する横浜市立大学倫理委員会の承認をうけ実施した。 - 医師用調査票(資料1)の記載
● 発熱の初日を「第1病日」とし、その後7病日まで最高体温を記載。 ● 1日を<午前><午後><夜>と3つに大分化。<午前>とは、朝6時から正午まで、<午後>は、正午より夕方6時まで、<夜は>夕方6時から翌朝6時まで、とした。 ● 「臨床症候」については医師の診察所見を記載。異常行動・言動については、参考のため調査用紙の裏面に、具体的な例文を掲載した。患児が該当する言動をみせた場合に該当症状にチェック。 ● 「治療薬」は、処方内容を内服開始時から記載とした。 ● チェック法は、症状がみられたら「レ」、症状が判らない場合は「?」、症状がなかった場合には「空欄」とした。 ● 病状が悪化し、他院へ転送された場合には、転送先の病院を記載することとした。 - 患者・家族用調査票(資料2)
● 説明文書と同意書(資料3)を事前に手渡し、協力を要請した。 ● 「発熱」については、初めて発熱をみた日を「第1病日」とし、その後、「第7病日」までについて、その日のうちでの最高体温を記載していただくこととした。 ● 「症状」については、調査用紙の裏面に症状の具体的な例文を掲載し、参考にしていただいた。
(1)第1病日から第7病日までに、それぞれの症状がみられたか否かについて、「1.あり、 2.なし、3.不明」に○印をつけていただいた。なお、乳幼児では、筋肉痛、関節痛、耳痛、咽頭痛、頭痛などは訴えられない場合があることも明記。「3.」(不明)は、症状の有無について判断ができない場合に限り記載していただくこととした。
(2)症状が「1.」(あり)の場合には、症状が見られた病日(朝・昼・夜別)に□の中に「レ」を記入し、症状があったか否かが不明な場合には「?」症状がなかった場合は「空欄」としていただいた。
(3)<朝>は朝6時から正午まで、<昼>は正午より夕方6時頃まで、<夜>は夕方6時頃から翌朝6時頃まで、という定義も明記。● 「治療薬」については、担当医に処方された内容を参考にしていただいた。
(1)各薬剤使用の有無について該当する番号に○印。
(2)薬剤を使用した場合には、その使用時期を朝・昼・夜の該当する□の中に「レ」を記入し、使用しなかった時期は「空欄のまま」に。● 不明の点があったら、担当医に尋ねるように指導。
C.結果(資料4)
| ● | 医師からは2,846件、患者・家族からは2,545件の回答を得られた(資料4-1)。 |
| ● | 対象患児は、ほぼ平均的に小児年齢を網羅しており、ワクチン接種においては2回接種済が35.9%に過ぎなかった。また、けいれんの既往は4.3%でみられた(資料4-2)。 |
| ● | 38℃以上の高熱が出現するのは、第1、2病日である。異常言動出現者は10.5%と従来の報告と比較して高頻度にみられたが、この解釈には今後の検討が必要である。その他の臨床症候については、けいれん(0.6%)、熱性けいれん(2.6%)、意識障害(1.3%)、肺炎(1.4%)、クループ(1.7%)、中耳炎(1.3%)、筋炎(1.0%)と従来の成書に記載してある随伴症状の頻度と同程度であった(資料4-3(1))。薬物面では、タミフルが90.0%と大多数の患者に使用されていた。アセトアミノフェンは39.6%、抗菌薬は全体で28.0%と余り使用されていなかった(資料4-3(2))。これは、迅速診断で本症と診断が付くと、抗菌薬が処方されなくなったと推測できる。 |
| ● | 各臨床症候の発現時期は、第1あるいは2病日に90%前後集中していた。特に異常言動の随伴は、両病日で95.6%を占めていた。但し、中耳炎の発症はこの範疇に属さず第7病日まで数%ずつの発症が続いた(資料4-4)。 |
| ● | 薬剤の使用時期では、第1あるいは2病日にアセトアミノフェンは95.4%、タミフルは91.8%が処方されていた。抗菌薬については、第3病日以降も投与されていた(資料4-5)。 |
| ● | 臨床症候の発現期間は、異常言動、けいれん、熱性けいれん、意識障害は1日ないし2日間と比較的短期間であった(資料4-6)。 |
| ● | 薬剤使用状況と臨床症状との関連性について検討したところ、タミフルと異常言動との関連性はタミフルを未使用での発現頻度は10.6%であったのに対し、タミフル使用では11.9%と有意差を認めなかった。なお、同じ期間に異常言動発現とタミフル使用があった場合に、異常言動発現前にタミフルを使用したと仮定した場合のハザード比は1.16で、p値0.259で有意差はなく、一方、異常言動発現後にタミフル使用したと仮定した場合のハザード比は0.90であり、p値0.463でやはり有意差は認められなかった(資料4-7(1))。この点は、今回の調査が厳密な時間的推移について記載するようになっていなかったので、タミフル内服と異常言動発現の時間的差異についての検討が行えなかった。次回の調査はこの点を追究するものにすべきであると考えられた。 |
| ● | 肺炎合併についてみると、タミフル未使用での累積発生率は3.1%、タミフル使用では0.7%であり、また肺炎はタミフル使用前に併発したと仮定した場合のハザード比0.24(p値<0.0001)、使用後に併発したと仮定した場合には0.20(p値<0.0001)で、いずれの場合でもタミフルは肺炎を抑制していた(資料4-7(5))。クループの併発についても、タミフルは抑制していた(資料4-7(6))。 |
| ● | タミフル使用とけいれん、熱性けいれんあるいは意識障害の出現、中耳炎・筋炎の併発の間には相関性が認められなかった(資料4-7(2)~(4)、(7)、(8))。 |
| ● | アセトアミノフェンを使用したものでは、異常言動、けいれん、熱性けいれん、意識障害等の臨床症候の出現が有意に増加していた(資料4-8(1)~(4))。 |
| ● | アセトアミノフェン使用と肺炎・クループ・中耳炎・筋炎の併発の間には相関性が認められなかった(資料4-8(5)~(8))。 |
| ● | マクロライド系抗菌薬を使用したものでは肺炎の併発が増加(資料4-9)、ペニシリン系抗菌薬では中耳炎の併発が増加(資料4-10)、セフェム系抗菌薬では異常言動の出現阻止、肺炎・クループの併発の増加(資料4-11(1)~(3))という関連性がみられた。 |
| ● | 「患者家族用調査票」からも、38℃以上の高熱が出現するのは、平均して第1、2病日に限ることが判明した。異常言動は、おびえ・恐怖8.7%、幻視・幻覚5.9%、突然大声・うわごと12.8%、怒り出す・ニヤリとする8.5%、指を食物のように0.7%の頻度がみられた。その他の臨床症候については、けいれん(3.1%)、意識消失(1.5%)、ひどい咳(41.1%)、嘔吐・下痢(35.0%)、咽頭痛(40.4%)、頭痛(40.9%)であった(資料4-12)。 |
| ● | 異常言動・けいれん・意識消失の出現は第1病日の夜に多く認められた(資料4-13(1))。また、耳の痛みは第5病日まで発現時期が遷延していた(資料4-13(2))。 |
| ● | 投与された薬剤としてはタミフルが最も多く、第1あるいは2病日に92.1%が投与されていた(資料4-14)。 |
| ● | おびえ・恐怖、幻視・幻覚、突然怒り出すなどの症状において、タミフル未使用群とタミフル使用群の累積発生率の間に有意な差異はみられなかった(資料4-15(1)、(2)、(4))。突然大声・うわごとについては、同一期間内での症状発現とタミフル使用との仮定によって、関連の様式が異なっていた(資料4-15(3))。 |
| ● | タミフルはひどい咳の抑制に大きく関与(ハザード比 0.69(p<0.0001))していた(資料4-15(5))。 |
| ● | 臨床症候の発現には薬剤以外の要因も関連していることから、多変量解析による検討を行なった。この結果、異常言動の発現に関与する因子は年齢、全経過を通じた最高体温(40.0℃以上)であることが判明した(資料4-16)。 |
| ● | 性別、年齢、ワクチン接種、気管支喘息、けいれん、発熱を多変量調整した結果、タミフルと異常言動については、ハザード比は1.07(p=0.647)で明らかな相関性を持たなかった(資料4-17(1))。 |
| ● | 上記多変量調整の結果、タミフルとけいれん、熱性けいれん、意識障害の出現についても明確な関連性は認められなかった(資料4-17(2)~(4))。 |
| ● | 同様に多変量調整によって関連要因の影響を調整した結果、アセトアミノフェンと熱性けいれんの関連はみられなくなった(資料4-17(3))。しかしながら、異常言動、けいれんについては依然として増加の傾向(有意水準10%)が残り(資料4-17(1)、(2))、意識障害は有意に増加していた(資料4-17(4))。今後、さらに精度の高い調査を実施し、確認する必要がある。 |
| ● | 上記多変量調整の結果、タミフルは肺炎の併発抑制に、セフェム系抗菌薬は併発増加に有意に関連していた(資料4-17(5))。 |
D.結論
| ● | 今回の解析では、約2,500例の症例について、医師側からと患者・家族側の双方から、調査が実施できた。 |
| ● | 医師および患者家族に調査票を個別に配布することによって、より精度の高い情報を得ることが可能となった。 |
| ● | 異常言動の出現率は従来の報告と比較して10%と非常に高い値を示した。異常言動の定義および内容に曖昧な点があり、また昨年末よりメディアを中心にインフルエンザの異常言動についての報道が繰り返されてきたために、過剰に報告された可能性がある。結論は来年度以降の調査の結果に持ち越しとしたい。 |
| ● | 今回の実態調査では発熱後7日間の各病日について「朝・昼・夜」と区分した期間において服薬と臨床症候について調査したが、同一の期間に服薬開始と臨床症候新規発現が起きた場合には両者の時間的前後関係を特定できなかった。 |
| ● | 異常言動をはじめとする各臨床症候の発現時期は、第1あるいは2病日に90%前後集中していたことより、この時期の詳細な検討が今後重要になった。 |
| ● | 多重解析の結果、タミフルと異常言動、けいれん、熱性けいれん、意識障害出現の関連には明らかな有意性はなかったが、明確な結論を導くためには今後の検討が必要である。 |
| ● | 今回の調査は、病因的にも社会的にも重要な点を捉えていると思われ、今後さらに時間経過を綿密に追った大規模な検討が必須である。 |
| ● | インフルエンザは他の風邪症候群と比較して、様々な随伴症状を呈することから、決して軽い病気でないことが再確認できた。 |
E.来年度以降の調査についての課題
| ● | 発現時期が第1、2病日に多かったことから、調査をこの期間に限定し、異常言動の詳細な内容をコメントに記載してもらうよう適切な指示を行い、時間的経過(特に服薬との関係)を記載してもらうように調査票を修正する。 |
| ● | 調査する圏を広げ、より大規模な調査を行う方向を考えていく。 |
| ● | より質の高いデータを得るためには、リアルタイムで得られた情報を処理していく必要がある。 |
| ● | 次シーズンにおいて随伴症状と薬剤使用との時間的関係をより詳細に検討する調査が必要であろう。 |
|
お知らせ 医薬品・医療機器等安全性情報は, 医薬品医療機器情報提供ホームページ(http://www.info.pmda.go.jp/)又は厚生労働省ホームページ(http://www.mhlw.go.jp/)からも入手可能です。 |
