電子化された添付文書の閲覧方法
医薬品等の外箱に表示されているバーコードをスマートフォンやタブレットのアプリケーションなどを使って読み取り、その情報をもとにインターネットを経由して最新の電子化された添付文書(以下、「電子添文」という。)を閲覧します。また、電子添文の他、審査報告書などの関連文書も閲覧することが可能です。具体的な閲覧イメージは下記の図をご覧ください。
なお、一般用医薬品等の消費者が直接購入する製品については、紙の添付文書が同梱されています。添付文書電子化の対象品目の詳細及び経緯については、下の添付文書電子化関連通知の厚生労働省の通知「医薬品等の注意事項等情報の提供について」をご覧ください。
【表示画面変更のお知らせ】
2025年3月、関連文書一覧画面を一般の方にもより親しみやすいデザインにリニューアルいたしました。詳細は本ページに掲載しております「デザイン変更後の画面について」をご覧ください。なお、デザインのリニューアルに伴い、表示項目を一部見直しました。
デザイン変更後の画面について[826.33KB]
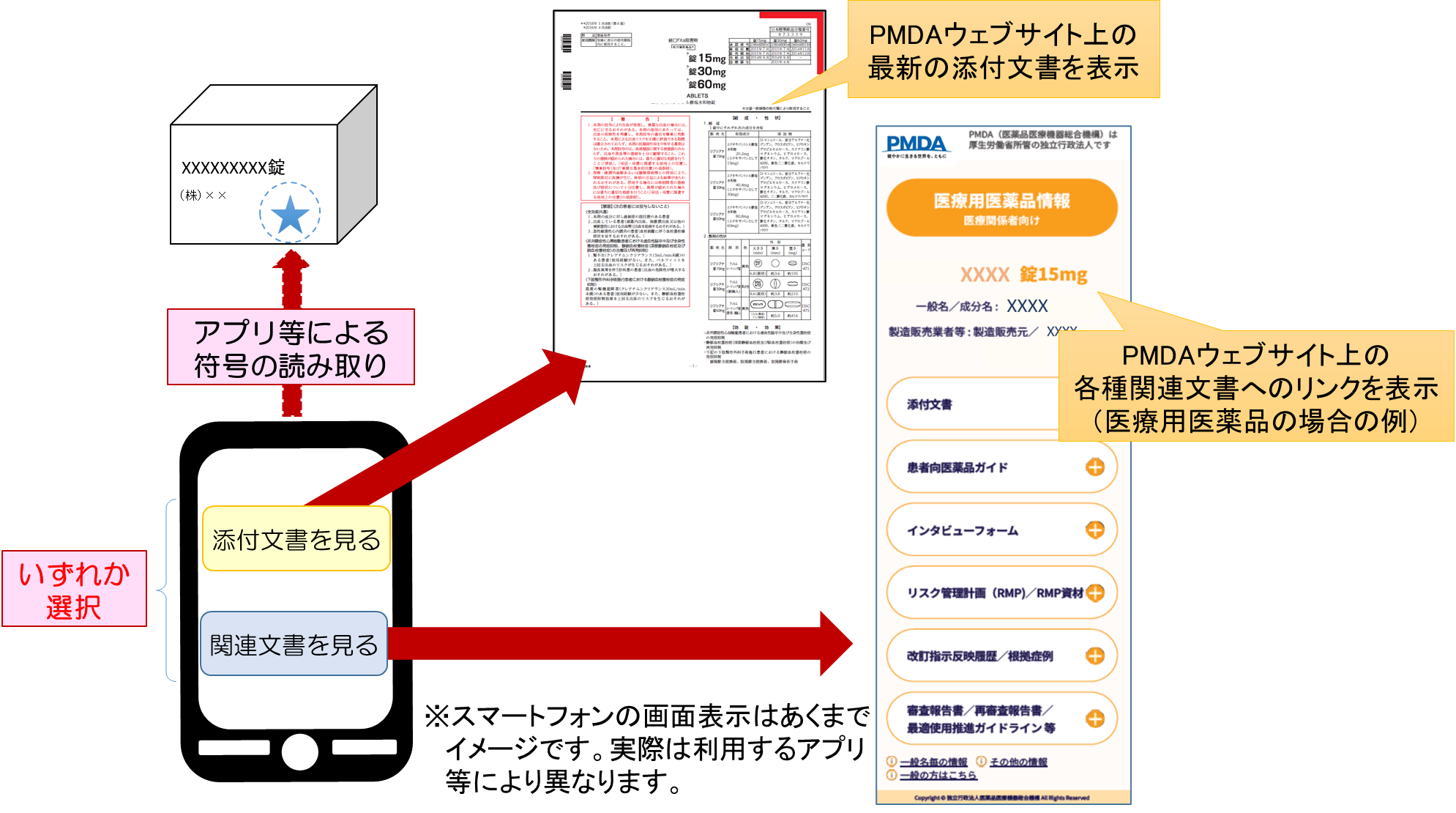
表示される関連文書
| 品目 | 表示される関連文書 |
|---|---|
| 医療用医薬品 (医療関係者向け) |
電子添文、患者向医薬品ガイド/ワクチン接種を受ける人へのガイド、インタビューフォーム、医薬品リスク管理計画(RMP)、RMP資材、改訂指示反映履歴および根拠症例、審査報告書/再審査報告書/最適使用推進ガイドライン等 |
| 医療用医薬品 (一般の方向け) |
患者向医薬品ガイド/ワクチン接種を受ける人へのガイド、RMP資材(患者向け)、重篤副作用疾患別対応マニュアル |
| 医療機器 | 電子添文、改訂指示反映履歴、審査報告書/再審査報告書等、緊急安全性情報/リスク管理計画(RMP)、RMP資材 |
| 体外診断用医薬品 | 電子添文、緊急安全性情報、安全性速報、医薬品の適正使用等に関するお知らせ |
| 再生医療等製品 | 電子添文、改訂指示反映履歴、審査報告書/申請資料概要/最適使用推進ガイドライン等、緊急安全性情報、安全性速報 |
外箱のバーコードを読み取るアプリ等について(注)
添文ナビ
【開発・運営元】(一財)流通システム開発センター(GS1 Japan)、日本製薬団体連合会、(一社)日本医療機器産業連合会
【ダウンロード】以下の各公式ストアより可能
App store
Google play
なお、アプリの操作説明等の添文ナビに関する資料は以下GS1 Japanウェブサイトからご覧いただけます。
https://www.dsri.jp/standard/healthcare/tenbunnavi/app/index.html
【参考】2021年5月10日付け事務連絡「医薬品等の容器等に記載された符号を読み取ることで注意事項等情報が掲載されている機構のホームページを閲覧するスマートフォン等のアプリケーションについて[1.56MB]」
(注)アプリの仕様等についてはアプリ開発元へお問い合わせください。
外箱のバーコードからのリンクに関する技術的情報
外箱のバーコードからの電子添文へのアクセスの仕組みについて、現時点の情報を公表しています。
仕様の詳細について(GTIN版)[1.13MB]
YJコードからのリンクに関する技術的情報(医療用医薬品)
電子版おくすり手帳などから、PMDAウェブサイト上の一般の方向け情報にアクセスできるよう、医療用医薬品のYJコードを利用して関連文書一覧にアクセスできる仕組みを開発しました。
仕様の詳細について(YJコード版)[1.31MB]
添付文書電子化関連通知
