HBDとは
HBD(Harmonization By Doing)は、日米両国の産官学が協力し、臨床試験や承認審査の実践を通して、日米における医療機器規制の調和を図る活動です。
構成メンバーは下記の通りです。
| 官: | 日:厚生労働省/PMDA | 米:米国FDA |
| 学: | 日:学会・大学・医療機関の専門家 | 米:DCRI他、学会・大学・医療機関の専門家 |
| 産: | 日:日本医療機器産業連合会(医機連)他 | 米:POC参加企業、AdvaMed他 |
循環器領域の医療機器を中心として、米国FDA(FDA HBDホームページ)との意見交換を行いながら、国際共同臨床試験の推進、日米間で協力して審査を実施する体制の構築、効率的かつ迅速な審査を進めるための施策の検討を行い、我が国としては、医療機器承認のタイムラグの改善を図ることを目指しています。
DCRI:Duke Clinical Research Institute
HBDパンフレット
HBDの活動をまとめたパンフレットです。ご自由にダウンロードください。
HBD組織図
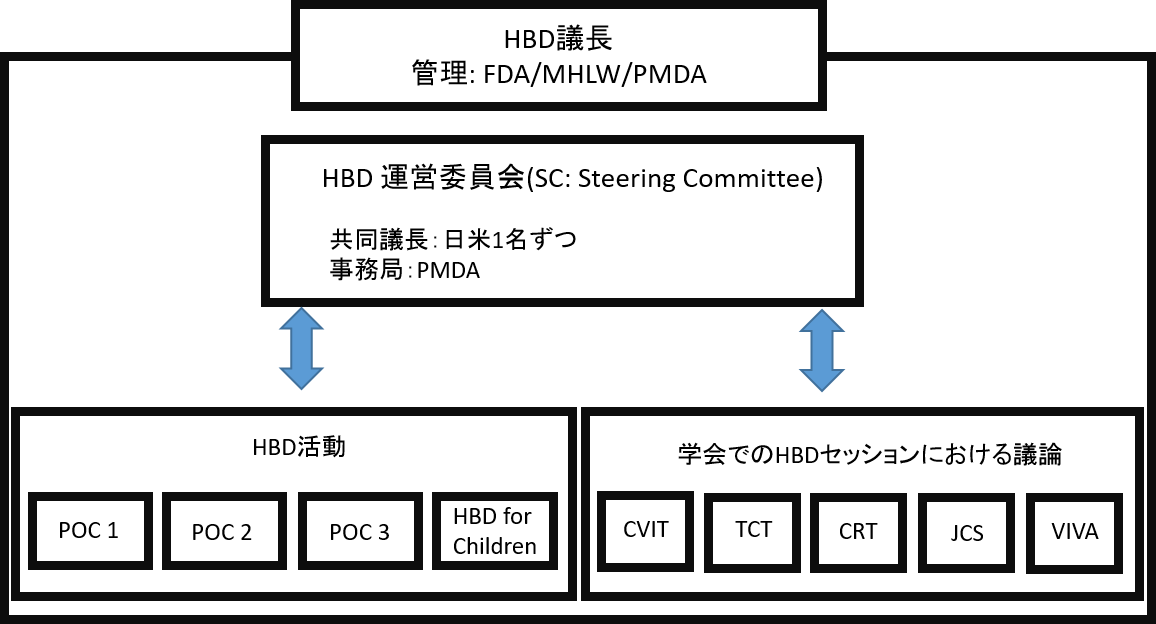
(2019年1月現在)
CVIT:日本心血管インターベンション治療学会
TCT:心臓血管カテーテル学会
CRT:Cardiovascular Research Technologies Conference
JCS:日本循環器学会
VIVA:Vascular Interventional Advances Conference
History
心血管系の医療機器の承認審査の日米の規制の整合化を図ることを目的として、2003年12月に日米両国の官・学・産が共同して活動を始めました。
2003年12月の最初の会合以降、think tank形式の会議が開催され、2005年12月の東京会合では「薬剤溶出ステント」を例として、日米で並行した治験、申請、審査、承認を行うための問題点の整理と解決の方向性、HBDのあり方について検討を行いました。2006年7月以降、米国FDAと厚生労働省が全体作業を管理する組織体制をとっています。
HBDの利点
日米の規制当局の審査官は、有効性・安全性に関する同様な科学的観点から懸念・疑問を持ち、申請者に質問を投げかける一方、見解の多様性も想定されます。
HBDは、以下のような成果を通じて、将来、革新的技術による安全で有効な新医療機器をより早く患者の元に届けることに貢献できるものです。
- より厳密に計画されて実施される臨床試験
- 臨床試験の実施基盤の改善
- より良い臨床試験データ
- どのように日米の経験が相互に補完するかについてのより良い理解
- 日米両国の患者にとって恩恵のある新しい治療法や医療機器の早期承認への新しいアプローチ
- 日米の承認の時間差を縮める機構
- 規制当局、産業界、臨床研究者、患者、学会が国際協力する環境
- 国際調和における継続的進展
主な成果
<国際共同臨床試験>
- 薬剤溶出型ステントの日米共同臨床試験の実施による、国際共同臨床試験における課題の解決及び国際共同開発の促進
<レジストリのデータ調和(Harmonization by Data)>
- 補助人工心臓レジストリJ-MACSの米INTERMACSとのデータ調和
- J-TAVRレジストリのUS TAVRレジストリとのデータ調和
<評価指針の作成>
- CLI(重症下肢虚血)治療デバイスに関する日米共通の評価指標作成(下記論文公表済み)
Design Strategies for Global Clinical Trials of Endovascular Devices for Critical Limb Ischemia (CLI) - A Joint USA-Japanese Perspective - Hiroyoshi Yokoi et al. Circ J. 2018 Aug 24;82(9):2233-2239
HBDから派生した取組み
医療機器の対面助言及び承認審査に係る米国FDAとの情報交換
浅大腿動脈用ステントの日米共同臨床試験実施、同時申請/承認の達成
