(注釈1)出典:WHO Expert Committee on Specifications for Pharmaceutical Preparations
医薬品の審査において、審査の迅速化や審査に必要な提出資料の軽減等のためにリライアンスを活用することを簡略審査といいます。医薬品の簡略審査制度の詳細は国・地域によって異なりますが、PMDAを参照規制当局としている国・地域では、申請者が承認申請時にPMDAの審査報告書を添付することで、当該国における審査手続きの効率化、審査期間の短縮等が期待されます。
PMDAは、アジア各国・地域での医薬品アクセスの向上に貢献するため、海外規制当局及び関係団体と協力し、PMDA審査報告書を活用した簡略審査申請の促進に努めています。
日本を参照する国・地域
日本を参照している国・地域の一覧は以下のとおりです。このリスト中の「医薬品審査の迅速化」は、当該国・地域においてPMDAの審査報告書を活用した医薬品の簡略審査制度が設けられていることを意味します。
2025年10月現在のリスト[360.29KB]
アジア各国の簡略審査手順概要
アジア各国から提供された簡略審査手順に関する概要は以下のとおりです(2025年11月時点)。簡略審査制度を利用した承認申請の詳細については、各医薬品規制当局が公表している最新情報を確認してください。
(参考情報)
The 22nd DIA Japan Annual Meeting 2025 発表資料
The 11th Thailand-Japan Symposium 発表資料
PMDA審査報告書英訳の作成
申請先の規制当局からPMDA審査報告書の英訳を求められている場合、申請者がマスキングなしの英訳審査報告書を用意して提出します。PMDA審査報告書の英訳作成手順を下図に示します。PMDAが審査報告書の英訳をしない場合(1)と、PMDAが審査報告書の英訳版を公表する場合(2)に分けて説明します。
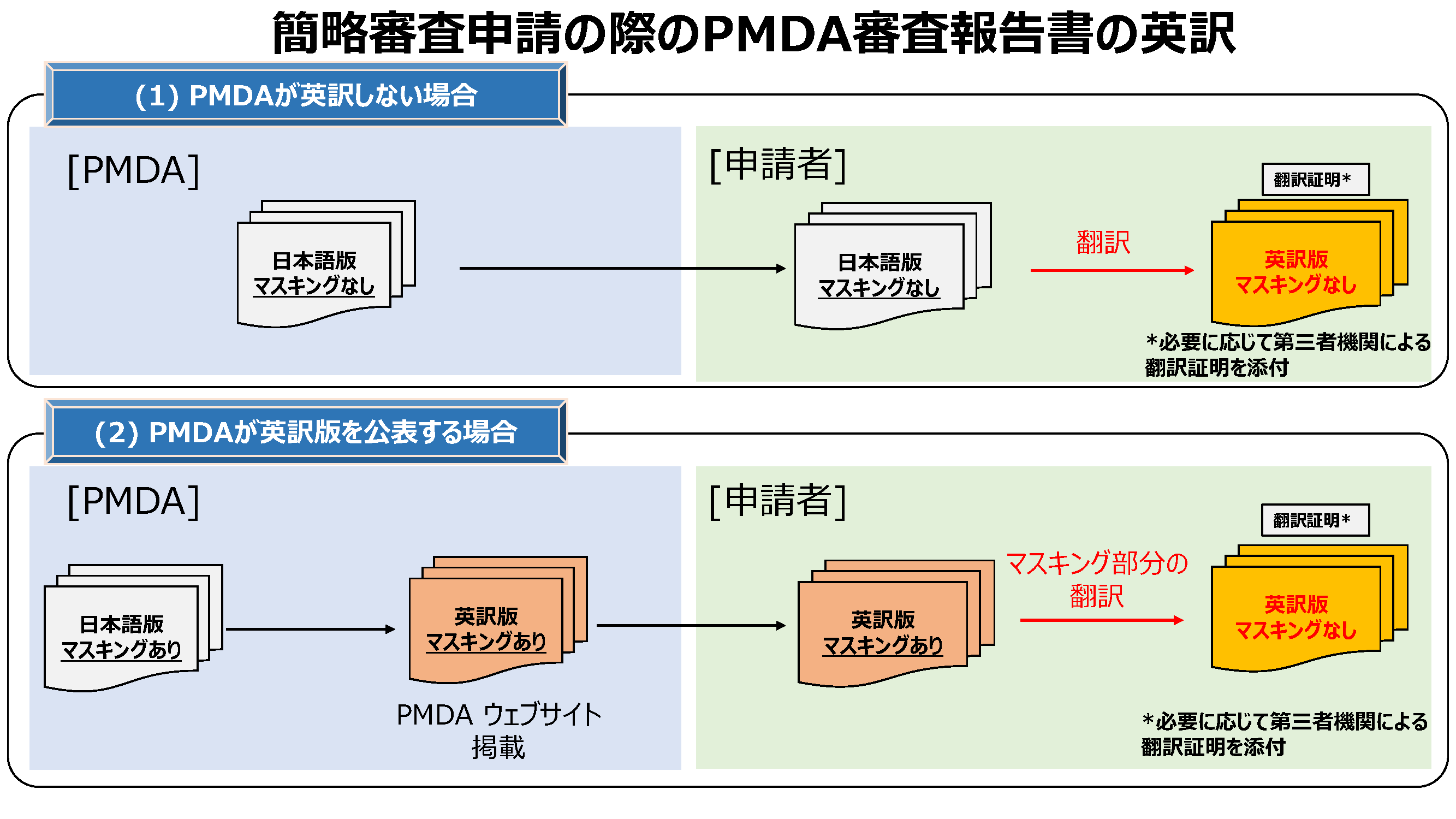
(1)PMDAが審査報告書の英訳をしない場合
申請者は、審査報告書(マスキングなし)を翻訳し、必要に応じて第三者機関による翻訳証明を添付して、当該国・地域の規制当局に提出してください。
(2)PMDAが審査報告書の英訳版を公表する場合
PMDAの英訳審査報告書はこちら
申請者は、PMDAのホームページに掲載されている英訳した審査報告書(マスキングあり)のマスキング部分を翻訳し、必要に応じて第三者機関による翻訳証明等を添付して、当該国・地域の規制当局に提出することが可能です。
カバーレター
PMDAの英訳審査報告書のカバーレターとして、日本製薬工業協会(JPMA)作成の様式をご利用ください。
(注)PMDAはアジアの各規制当局に対し、日本の申請者が簡略審査希望の場合にカバーレターを添付することを伝えています。
ASEAN共同審査(AJA : ASEAN Joint Assessment)
ASEAN共同審査では、ASEAN加盟国が医薬品の承認審査を共同で行い、審査報告書を作成します。承認の可否の判断は各国がそれぞれ行います。本審査においても参照する規制当局が指定され、部分的にリライアンスが活用されています。ASEAN共同審査手順に関する概要は以下のとおりです(2025年11月時点)。ASEAN共同審査を利用した承認申請の詳細については、ASEAN又は各医薬品規制当局が公表している最新情報を確認してください。
(参考情報)
The 22nd DIA Japan Annual Meeting 2025 発表資料
問合せ先
(注)迷惑メール防止対策のため、送信の際は[at]を@に置き換えてください。
医薬品医療機器総合機構 ATC・二国間協力部
E-mail:PMDA-GD[at]pmda.go.jp
