日程調整依頼書受付日等の予定について
日程調整依頼書受付日及び機構から相談申込者への日程連絡日
日程調整依頼書の月初受付日の日程(2026年1月受付分まで)[226KB]
日程調整依頼書の月初受付日の日程(2026年3月受付分まで)[232KB]
(注) 医薬品/再生医療等製品添付文書改訂事前確認相談は、随時受付します。
資料搬入日
実施方法について
- 希望する実施方法を相談の日程調整依頼書に記載してください。
- Web会議の実施を希望される場合は、「Web会議による対面助言等の実施に関する基本確認事項」を日程調整依頼書とあわせてご提出ください。
- 日程調整依頼書提出時にWeb会議を希望しなかった相談で、Web会議にて実施することとなった場合は、その時点で担当審査部担当者にWeb会議基本確認事項を提出してください。
- 実施方法は、会議室や機材等を踏まえて機構の相談担当部において決定します。ご希望に添えない場合がありますので予めご了承ください。面会形式の場合でも、機構の出席者の一部がWeb会議形式で出席することがあります。
- 詳細は、「対面助言等におけるWeb会議システム利用要綱」(実施要綱等通知の別添23-2)[100KB]をご確認ください。
医薬品/再生医療等製品添付文書改訂事前確認相談及び医薬品/再生医療等製品添付文書改訂相談について
2.1.相談区分
詳細は実施要綱等通知の別添27[216KB]をご覧ください。
1.医薬品添付文書改訂事前確認相談
新たに得られた製造販売後臨床試験等の結果に基づき、添付文書における効能又は効果に関連する注意、用法及び用量に関連する注意、臨床成績等の改訂(削除、追加、記載内容の変更)を希望する医薬品について、医薬品添付文書改訂相談の申込みに先立ち、医薬品添付文書改訂相談を実施することの可否、相談事項、提出資料の内容、相談実施時期、専門協議の実施可能性、医薬品添付文書改訂根拠資料適合性調査相談免除の可否等について検討・確認するもの。なお、医薬品添付文書改訂根拠資料適合性調査相談の事前面談と同時期に実施することが可能。
2.医薬品添付文書改訂相談
新たに得られた製造販売後臨床試験等の結果に基づき、添付文書における効能又は効果に関連する注意、用法及び用量に関連する注意、臨床成績等の改訂(削除、追加、記載内容の変更)を希望する医薬品について、有効性・安全性に係る評価を実施した上で、添付文書改訂の可否を評価し報告書を作成するもの。医薬品添付文書改訂相談の実施を希望する場合は、相談申込みに先立ち、医薬品添付文書改訂事前確認相談により、医薬品添付文書改訂相談実施の可否等について、確認を受けること。なお、添付文書改訂に当たっては、医薬品添付文書改訂根拠資料適合性調査相談又は医薬品再審査適合性調査相談において、添付文書改訂の根拠となる製造販売後臨床試験等の資料について信頼性に影響を及ぼすと思われる事項がないことが確認されている必要がある。ただし、医薬品添付文書改訂事前確認相談にて医薬品添付文書改訂根拠資料適合性調査相談又は医薬品再審査適合性調査相談を実施する必要がないと判断された場合は、この限りでない。
3.再生医療等製品添付文書改訂事前確認相談
新たに得られた製造販売後臨床試験等の結果に基づき、添付文書における効能、効果又は性能に関連する注意、用法及び用量又は使用方法に関連する注意、臨床成績等の改訂(削除、追加、記載内容の変更)を希望する再生医療等製品について、再生医療等製品添付文書改訂相談の申込みに先立ち、再生医療等製品添付文書改訂相談を実施することの可否、相談事項、提出資料の内容、相談実施時期、専門協議の実施可能性、再生医療等製品添付文書改訂根拠資料適合性調査相談免除の可否等について検討・確認するもの。なお、再生医療等製品添付文書改訂根拠資料適合性調査相談の事前面談と同時期に実施することが可能。
4.再生医療等製品添付文書改訂相談
新たに得られた製造販売後臨床試験等の結果に基づき、添付文書における効能、効果又は性能に関連する注意、用法及び用量又は使用方法に関連する注意、臨床成績等の改訂(削除、追加、記載内容の変更)を希望する再生医療等製品について、有効性・安全性に係る評価を実施した上で、添付文書改訂の可否を評価し報告書を作成するもの。再生医療等製品添付文書改訂相談の実施を希望する場合は、相談申込みに先立ち、再生医療等製品添付文書改訂事前確認相談により、再生医療等製品添付文書改訂相談実施の可否等について、確認を受けること。なお、添付文書改訂に当たっては、再生医療等製品添付文書改訂根拠資料適合性調査相談(本通知の別添20-3)において、添付文書改訂の根拠となる製造販売後臨床試験等の資料について信頼性に影響を及ぼすと思われる事項がないことが確認されている必要がある。ただし、再生医療等製品添付文書改訂事前確認相談にて再生医療等製品添付文書改訂根拠資料適合性調査相談を実施する必要がないと判断された場合は、この限りでない。
2.2.手数料表
| 相談区分 | 手数料額 |
|---|---|
|
99,200円 |
|
4,987,400円 |
|
99,200円 |
|
4,987,400円 |
相談の流れ(概要及び手続)
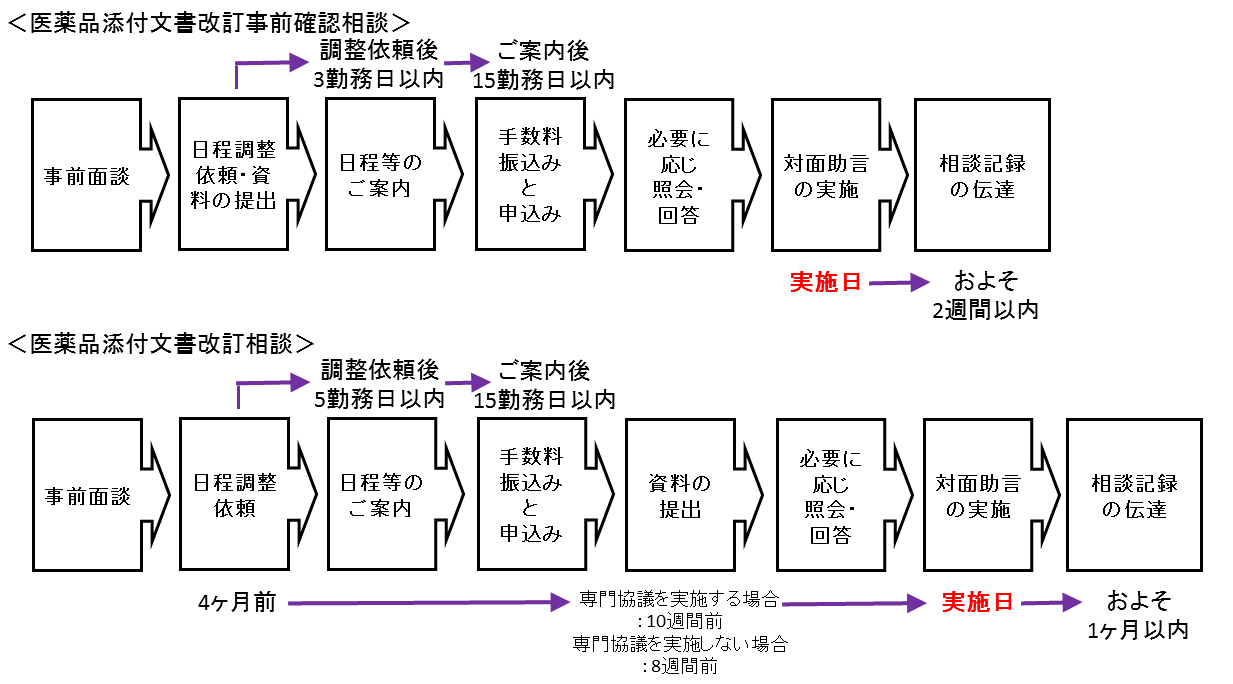
(注)再生医療等製品添付文書改訂事前確認相談・再生医療等製品添付文書改訂相談についても同じ
注意事項
申込書等に記載される内容、特にご担当者の連絡先(電話番号、ファクシミリ番号、電子メールアドレス)に間違いがないことをご確認の上、各種書類を提出くださいますようお願いいたします。
3.1.事前面談
対面助言を円滑に進めるため、事前に相談項目の整理等を行うものです。事前面談の申込手順等の詳細は、事前面談のWebページをご確認ください。
3.2.日程調整依頼
医薬品/再生医療等製品添付文書改訂事前確認相談
対面助言申込書の表題部分を「医薬品/再生医療等製品対面助言日程調整依頼書(添付文書改訂に係る相談)」と書き換え、必要事項を入力し、電子メールにより審査マネジメント部審査マネジメント課に提出してください。また、以下の資料を日程調整依頼書の別紙又は別添として併せて提出してください。
- 製造販売後臨床試験等の実施に至った経緯及び結果の概要を示した資料
- 添付文書改訂案(新旧対照表)及び改訂の経緯・理由を示した資料
- 改訂の根拠となる試験が海外試験であり、かつ医薬品/再生医療等製品添付文書改訂根拠資料適合性調査相談又は医薬品再審査適合性調査相談における調査の免除を希望する場合には、調査免除が可能と判断した根拠資料(海外規制当局による査察結果又は当該資料が海外規制当局により同様の調査等を受けたことを客観的に示す資料)
受付時期
月曜日から金曜日(国民の休日を除く)、午前9時30分から正午(厳守)
申込先及び問合せ先はこちら
様式ダウンロード等
- 様式第40号:医薬品/再生医療等製品対面助言申込書(添付文書改訂に係る相談)(表題の申込書を日程調整依頼書に書き換えてご利用ください)
(注) 希望する実施方法を記入し、Web会議の実施を希望の場合は、「Web会議による対面助言等の実施に関する基本確認事項」をあわせてご提出ください
- 様式第57号:Web会議による対面助言等の実施に関する基本確認事項
(注) 相談申込者の押印は不要です。
メール提出時のお願い
- 日程調整依頼書は、テキスト認識可能なファイル(PDF等)で提出してください。
- メールの件名は、「日程調整依頼書_会社名、薬剤名等」としてください。同一品目について複数の相談を同日に申し込む場合には、末尾に(1)、(2)等と附番してください。
例)日程調整依頼書_XX製薬、XX錠
医薬品/再生医療等製品添付文書改訂相談
対面助言申込書の表題部分を「医薬品/再生医療等製品対面助言日程調整依頼書(添付文書改訂に係る相談)」と書き換え、必要事項を入力し、電子メールにより審査マネジメント部審査マネジメント課に提出してください。
受付時期
原則として、相談を実施する月の4か月前の第1勤務日(受付日等の日程はこちら)、午前10時から午後4時(厳守)
様式ダウンロード等
- 様式第40号:医薬品/再生医療等製品対面助言申込書(添付文書改訂に係る相談)(表題の申込書を日程調整依頼書に書き換えてご利用ください)
(注) 希望する実施方法を記入し、Web会議の実施を希望の場合は、「Web会議による対面助言等の実施に関する基本確認事項」をあわせてご提出ください
- 様式第57号:Web会議による対面助言等の実施に関する基本確認事項
(注) 相談申込者の押印は不要です。
メール提出時のお願い
- 日程調整依頼書は、テキスト認識可能なファイル(PDF等)で提出してください。
- メールの件名は、「日程調整依頼書_会社名、薬剤名等」としてください。同一品目について複数の相談を同日に申し込む場合には、末尾に(1)、(2)等と附番してください。
例)日程調整依頼書_XX製薬、XX錠
3.3.実施等のお知らせ
日程調整結果は、受付日から起算して、医薬品/再生医療等製品添付文書改訂事前確認相談では原則3勤務日以内、医薬品/再生医療等製品添付文書改訂相談では原則5勤務日以内に文書「対面助言実施のご案内」にてお知らせいたします。
3.4.手数料振込と申込
「対面助言実施のご案内」を受信した日の翌日から起算して15勤務日以内又は資料搬入日のいずれか早い期日に、手数料を振り込んだ上で、「医薬品/再生医療等製品対面助言申込書(添付文書改訂に係る相談)」に振込金受取書等の写しを添付の上、審査マネジメント部審査マネジメント課に電子メールによりお申込みください。(電子メールによる提出が困難な場合は申込先までご連絡ください。)
様式ダウンロード等
- 様式第40号:医薬品/再生医療等製品対面助言申込書(添付文書改訂に係る相談)
(注) 相談申込者の押印は不要です。
メール提出時のお願い
- 日程調整依頼書は、テキスト認識可能なファイル(PDF等)で提出してください。
- 申込書提出時には電子メールの件名を次のように記載してください。:申込書_受付番号XX(会社名)
3.5.資料の提出
医薬品/再生医療等製品添付文書改訂事前確認相談
日程調整依頼書提出日に日程調整依頼書の別紙又は別添として提出してください。
医薬品/再生医療等製品添付文書改訂相談
- 提出方法
以下のいずれかにより審査マネジメント部審査マネジメント課へご提出ください。- 電子媒体1部(CD又はDVD)の郵送又は持参(提出先はこちら)
- 申請電子データシステム(ゲートウェイシステム)を利用したオンライン提出
- 提出日
「対面助言実施のご案内」に記載する日に提出してください。原則として、専門協議を実施する場合は対面助言実施予定日の10週間前の月曜日(午後3時まで)、専門協議を実施しない場合は対面助言実施予定日の8週間前の月曜日(午後3時まで)。(資料搬入日はこちら)
なお、専門協議を実施する場合は、専門協議の開催に係る専門委員の利益相反に係る資料を、「対面助言実施のご案内」受領後に相談担当者宛に提出してください。
提出資料の作成方法・提出にあたっての留意事項
- 搬入される対面助言の資料について(お願い)[293KB]
- 対面助言資料のゲートウェイ提出の方法・留意事項[473KB]
- 相談資料として申請電子データの提出を行う場合は、申請電子データに関するFAQのQ3-33を事前にご確認ください。
3.6.対面助言の実施
対面助言実施日の前日までに、出席者人数、相談者側専門家及び外国人の出席の有無(通訳出席の有無含む)について、機構の相談担当者まで連絡してください。
なお、出席人数については、会議室の広さとの関係上、1相談につき15名以内としてください。
基本的にはプレゼンテーションは実施しません。プレゼンテーションが必要な場合は、機構の相談担当者まで連絡してください。
対面助言のためにお越しになられる皆様へのお願い
対面助言のためにお越しになられる皆様へのお願いについて[9.2KB]
3.7.相談記録の伝達
対面助言が終了した後に、相談者に内容を確認の上、機構において記録を作成し、相談者に伝達します。
実施要綱・手数料等関連通知
医薬品/再生医療等製品添付文書改訂事前確認相談及び医薬品/再生医療等製品添付文書改訂相談についてのお申込先及びお問合せ先
独立行政法人 医薬品医療機器総合機構 審査マネジメント部 審査マネジメント課
〒100-0013 東京都千代田区霞が関3-3-2 新霞ヶ関ビル
- 電話(ダイヤルイン):03-3506-9556
- ファクシミリ:03-3506-9443
- 電子メール:shinyaku-uketsuke[at]pmda.go.jp([at]を半角のアットマークに置き換えてください。添付ファイルは10MBまでとしてください。1回のメールで送付できない場合は、受付後に担当者に直接送付してください。)
お問合せに関しては、午前9時30分から午後5時まで(土曜日、日曜日及び国民の祝日を除く)となっております。
