認定とは
外国において日本に輸出される再生医療等製品を製造しようとする者を、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下「医薬品医療機器法」という。)における再生医療等製品外国製造業者といい、 国内製造業者の許可と同様に、外国製造業者が医薬品医療機器法第23条の24による認定を受けていることが当該再生医療等製品の製造販売承認の要件となっています。
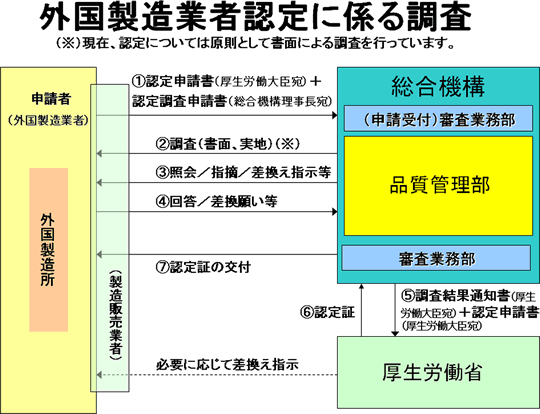
外国製造業者の認定権者は厚生労働大臣であり、認定のための外国製造所の構造設備の調査は機構が行います。認定は、区分に従って、製造所ごとに与えられます。
(参考)再生医療等製品の製造販売手順について[798KB]
(注)業者コード登録について【厚生労働省宛て】
認定申請に先立ち、当該外国製造業者及び製造所の業者コードの登録を厚生労働省宛てに行う必要があります。原則として「e-Gov 電子申請サービス」を利用して、業者コード登録票を提出してください。提出の手順は、厚生労働省のFD申請ウェブサイト内<e-Govを利用した業者コード登録マニュアル.pdf>を参照してください。
厚生労働省より発出された以下の通知の「1 業者コードの登録について」も必ずご一読ください。
認定申請について
(1)提出
医薬品医療機器法施行規則の様式第18による認定申請書(厚生労働大臣宛て)正副2通及び医薬品医療機器法施行規則の様式第16(2)による認定調査申請書(機構理事長宛て)を審査業務部業務第二課へ提出します。
外国製造業者の認定の手続については、当該外国製造業者の製造する再生医療等製品の製造販売業者等が代行することができますが、申請者はあくまでも外国製造業者になります。また、認定の有効期間である5年ごとに、更新を受ける必要があります。なお、更新の具体的な手続きは下記(4)を参照して下さい。
機構に対する認定調査申請手数料は、実地調査か書面調査かによって、その金額が異なりますが、 原則として、外国製造業者認定に係る外国製造所の構造設備調査のためだけに実地調査を行うことは予定していませんので、調査申請に際しては書面調査の手数料の振り込みをお願いします。審査等手数料・対面助言等の手数料について
認定に必要な標準的事務処理期間としては明記されたものはありませんが、国内の大臣許可製造所に対する許可について、 申請から許可までの事務処理期間の目安を概ね5か月程度としていることから、外国製造業者の認定についても、申請から5ヶ月程度を目安として下さい。
なお、新規に認定を取得する場合であって、同時に2以上の区分を1つの申請で申請することは できませんので、1つの区分の認定申請と同時に区分追加の認定申請(下記(3)参照)を提出して下さい。
(2)認定申請に必要な添付書類(医薬品医療機器法施行規則第137条の19)
- 製造所の責任者の履歴を記した書類
- 製造品目の一覧表(日本に輸出を予定している品目の一覧で差し支えない)及び製造工程に関する書類
「製造品目の一覧表」は、認定申請時に判明している範囲で記載してください。「製造工程に関する書類」 については、製造しようとする製品のどの工程に関するものであるかがわかる内容のものにして下さい。 - 製造所の構造設備に関する書類
製造所 の平面図等、認定対象施設が明らかになるなど、認定調査の事前資料として有用なものを提出して下さい。 - 当該外国製造業者が存する国が再生医療等製品の製造販売業の許可、製造業の許可、製造販売の承認の制度又はこれに相当する制度を有する場合においては、当該国の政府機関等が発行する当該制度に係る許可証等の写し
各種許可証等については、有効期限内のものを添付して下さい。
(3)外国製造業者の認定区分変更/追加申請
外国製造業者としての認定を受けた者は、当該製造所に係る認定の区分を変更し、又は追加しようとするときは、厚生労働大臣の認定を受けなければなりません。なお、いずれの申請も、医薬品医療機器法施行規則の様式第21による申請書を提出することにより行います。認定区分追加申請は、外国製造業者の認定を取得したあと、新たに他の認定区分を追加する場合に行います。
認定区分変更申請は、外国製造業者の認定を取得したあと、既認定の区分を廃止すると同時に、新たに他の認定区分を追加する場合に行います。
なお、この場合も新規認定申請時(上記(1)参照)と同様に、医薬品医療機器法施行規則の様式第16(2)による認定調査申請書も併せて提出して下さい。
認定区分変更/追加申請に必要な添付書類は次のとおりです。(医薬品医療機器法施行規則第137条の20で準用する第137条の14)
- 外国製造業者認定証(原本)
- 変更又は追加に係る製造品目の一覧表及び製造工程に関する書類
- 変更し、又は追加しようとする認定の区分に係る製造所の構造設備に関する書類
(4)外国製造業者の認定更新申請
外国製造業者の認定は、有効期間である5年ごとにその更新を受けなければ、その期間の経過によって、その効力を失います。 認定更新の申請は、医薬品医療機器法施行規則の様式第20による申請書を提出することにより行います。
なお、この場合も新規認定申請時(上記(1)参照)と同様に、医薬品医療機器法施行規則の様式第16(2)による認定調査申請書も併せて提出して下さい。
申請時期については、有効期限から極端に早い時期に申請されますと、認定がおりるまでの間に、申請内容に変更が生じる可能性がありますので、有効期限の5か月前を目処に申請していただくようお願いいたします。(事務処理期間の目安が5か月であるため)
従来は、更新申請にあたり新規申請と同様の添付資料を要求していましたが、みなし期間が終了したことに伴い、添付資料は次のとおりとし、その他の資料は不要です。
- 外国製造業者認定証(原本)
(注)区分追加を行っている場合は、区分追加認定書も併せて提出のこと。 - 構造設備の概要一覧表
- 他の試験検査機関等の利用概要)
- 無菌製剤作業所の構造設備の概要
【更新申請までに、薬事に関する業務に責任を有する役員・製造所の責任者・構造設備に変更がない場合】
認定更新申請書の備考欄に、「薬事に関する業務に責任を有する役員、製造所の責任者、構造設備の変更なし」と記載して下さい。
【更新申請までに、薬事に関する業務に責任を有する役員・製造所の責任者・構造設備に変更があった場合】
認定更新申請書の備考欄に、変更した内容を全て記載して下さい。
記載例 令和○○年○月○日変更届(製造所の責任者)提出済。
薬事に関する業務に責任を有する役員、構造設備は変更なし。
- 更新申請までに変更があった場合は、申請前に全ての変更届を提出しているかどうかを再確認し、届出漏れがある場合は、変更届も提出して下さい。
その他
(1)変更届(医薬品医療機器法施行規則第100条)
外国製造業者は、次の事項を変更したときは変更の日から30日以内に、医薬品医療機器法施行規則の様式第6による変更届書を厚生労働大臣宛てに届け出なければなりません。(届出の窓口は機構です。)
- 「外国製造業者」、「製造所の責任者」の氏名又は住所
- 外国製造業者が法人であるときは、薬事に関する業務に責任を有する役員の氏名
- 製造所の名称
- 製造所の構造設備の主要部分
- 外国製造業者が他の区分の製造業の認定を受けたとき、又はその製造所を廃止したときは、当該認定の区分及び認定番号
(注)製造所の所在地の変更に関する留意事項
移転等により所在地の変更があった場合については、新しく認定申請を行うことになるため、変更届による届出ではありませんので留意して下さい。単なる住居表示の変更による場合は、備考欄に「住居表示の変更による」等、その旨が分かる内容を記載して下さい。
(2)認定申請に関するお問合せ先
- 申請窓口への問い合わせ(審査業務部 業務第二課)
再生医療等製品に関する申請・届出等の手続きについてのご質問方法はこちらのページをご参照ください - 認定申請に係る構造設備調査についての問合せ(医薬品品質管理部(再生医療等製品担当))
電話番号: 03-3506-9446
参考通知等