お知らせ
- 6階西側総合受付での書類受け渡しの終了について(2023年12月より)
2023年12月以降、6階西側総合受付での書類受け渡しを行わなくなります。以降の書類受け渡しについては、本ページの案内通りとなります。
提出方法の詳細については、下記「1.申請・届出等の受付について」を、承認書等交付方法の詳細については、下記「4.承認書等の交付について」を参照してください。
- 医療機器、体外診断用医薬品及び再生医療等製品の使用成績評価(再審査)申請書の提出資料部数について(2023年3月より)
医療機器、体外診断用医薬品及び再生医療等製品の使用成績評価(再審査)申請時の提出資料部数はそれぞれ以下のとおりです。
- 申請書:正本1通、副本2通
- 添付資料:正本1通
- 安全性定期報告書、リスク管理計画書(RMP)及びその他の報告書の提出方法について(2022年12月26日)
2022年12月26日付けで安全性定期報告書、リスク管理計画書(RMP)及びその他の報告書の提出についての通知を発出しました。
提出方法の詳細については、下記「1.申請・届出等の受付について」を参照してください。
申請・届出等の受付について
- 申請書のチェックリスト[88.1KB]を掲載しました。提出前に一度ご確認ください。
- 製薬企業等の研究開発や薬事担当者向けの研修資料「医薬品承認申請実務担当者向け資料」のページで、2022年度研修資料「医薬品承認申請実務担当者向け資料」[1.62MB]を用意しております。受付から承認書等交付までの情報をまとめておりますので、参考までにご一読ください。
申請・届出等提出先について
(1)郵送による場合
レターパックライト/プラス等の信書便等や書留など、配達の記録が残る郵送の利用を推奨しております。
<送付先>
- 医薬品、医薬部外品、化粧品関係
独立行政法人医薬品医療機器総合機構 審査業務部業務第一課
〒100-0013 東京都千代田区霞が関3-3-2 新霞が関ビル6階
電話:03-3506-9437(ダイヤルイン) - 医療機器、体外診断用医薬品、再生医療等製品関係
独立行政法人医薬品医療機器総合機構 審査業務部業務第二課
〒100-0013 東京都千代田区霞が関3-3-2 新霞が関ビル6階
電話:03-3506-9509(ダイヤルイン)
(2)オンライン提出による場合
詳しくは、【申請等手続き】のページ及び同ページ内の「関連通知」をご参照ください。
(3)受付窓口による場合
9時30分から12時の間、予約制にて受付をいたします。
詳しくは、次の【2.申請・届出の受付窓口利用方法】をご参照ください。
- 部会等に係る資料の提出については、こちらのページをご覧ください
- 対面助言に係る資料の提出等については、本受付窓口ではございません
治験届の提出先について
2021年4月1日より、治験届の提出先は「審査マネジメント部審査企画課」へ変更となりました。
【治験計画届書等の受付については、こちらのページをご覧ください】
安全性定期報告書、リスク管理計画書(RMP)及びその他の報告書の提出先について
業務第一課宛て
- 安全性定期報告書
提出方法は、「郵送」もしくは「オンライン提出」です。
提出方法の詳細については、下記通知を参照してください。
<通知> 医薬品安全性定期報告の受付方法について(2022年(令和4年)12月26日事務連絡)[190KB]
通知別添 別添1[20.3KB](郵送) 別添2[20.1KB](オンライン)
- その他の報告書等(1.及び3.以外のもの)
提出方法は、「郵送」もしくは「オンライン提出」です。
提出方法の詳細については、下記通知を参照してください。
<通知> 安全性定期報告書及びリスク管理計画書を除く報告書等の受付方法について(2022年(令和4年)令和4年12月26日事務連絡)[183KB]
通知別添 別添1[20.5KB](郵送) 別添2[19.4KB](オンライン)
- 医薬品リスク管理計画書(RMP)
提出方法は、「メール提出」もしくは「オンライン提出」です。
提出方法の詳細については、下記通知を参照してください。
<通知> 医薬品リスク管理計画書(RMP)の提出方法について(2022年(令和4年)12月26日付事務連絡)[144KB]
医薬品リスク管理計画の策定及び公表について(2022年(令和4年)3月18日薬生薬審発0318第2号薬生安発0318第1号)[255KB]
通知別紙様式 別添様式1から3[49.5KB]
【1から3の宛先メールアドレス: ann-madoguchi[at]pmda.go.jp】
迷惑メール防止対策をしているため、送信の際は[at]を半角のアットマークに置き換えてください。
業務第二課宛て
- 使用成績調査報告書等(各種報告書・計画書)
提出方法は、「郵送」もしくは「オンライン提出」です。
提出方法の詳細については、下記通知を参照してください。
<通知> 申請書等のオンライン提出にかかる取扱い等について(2023年(令和5年)3月22日付け薬生薬審発0322第1号、薬生機審発0322第2号、薬生安発0322第1号、薬生監麻発0322第2号 (厚生労働省医薬・生活衛生局四課長連名通知))[2.65MB]
通知別添「オンライン提出に係る電子ファイル作成等要領 」 25.安全性定期報告等 参照
- 医療機器等リスク管理計画書(RMP)
提出方法は、「メール提出」です。
提出方法の詳細については、下記通知を参照してください。
<通知> 医療機器及び体外診断用医薬品のリスク管理計画の策定及び公表について(2020年(令和2年)8月31日薬生機審発0831第3号薬生安発0831第1号)[376KB]
【2の宛先メールアドレス: kikiann-madoguchi[at]pmda.go.jp】
迷惑メール防止対策をしているため、送信の際は[at]を半角のアットマークに置き換えてください。
メール提出時の留意事項
メールアドレスの受信サイズ上限は10MBとなっております。
添付ファイルが9MBを超える場合には、届かない可能性がございますのでご注意ください。
添付ファイルを分割するなどして、省サイズ化していただきますよう、お願いいたします。
また、「送信メールに添付したファイルがクラウドサーバーにアップロードされ、受信者は指定URLからダウンロードする」
といった企業のセキュリティ対策メールシステムを導入されている場合は、事前に宛先メールアドレスへ連絡してください。事前連絡が無いと、当日添付したファイルが確認できない場合がございます。
申請・届出等の受付窓口利用方法
<受付窓口の来訪の手順>
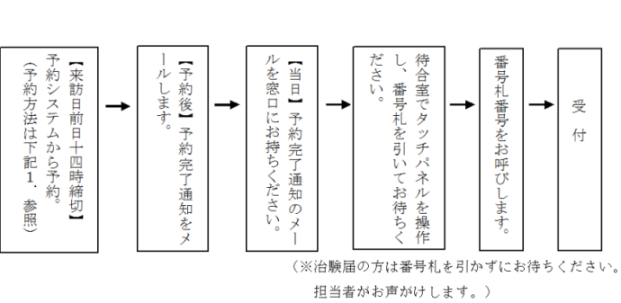
1.受付窓口の予約方法
次のリンクの予約システムから、予約を行ってください。

https://reserva.be/pmda_reservation
予約システムは株式会社コントロールテクノロジー社の「RESERVA予約」を使用しております。
注:2025年4月1日より予約システムを変更いたしました。予約時に登録いただく情報は従来から変更はございません。
注:2022年6月16日以降、Internet Explorerは動作確認対象外となりますので、他のブラウザに切り替えてご利用いただけますよう、お願いいたします。
(1)以下より区分を指定し、カレンダーから来訪される日時を指定してください。予約可能な時間帯のみ選択が可能となっています。予約区分と相談枠は以下のとおりです。
予約の受付時間は、予約をしようとする日の5日前の9時から予約日前日の14時までとなっています。キャンセルを出来る時間帯は予約日前日の15時までになります。
A 届出・申請書等提出(医薬品、医薬部外品、化粧品)
(15分毎×窓口数1)10枠
(時間の目安)9時30分、9時45分、10時、10時15分、10時30分、10時45分、11時、11時15分、11時30分、11時45分
B 届出・申請書等提出(医療機器、体外診断用医薬品・再生医療等製品)
(15分毎×窓口数1)10枠
(時間の目安)9時30分、9時45分、10時、10時15分、10時30分、10時45分、11時、11時15分、11時30分、11時45分
C 届出・申請書等提出(マスターファイル関係)
(30分毎×窓口数1)5枠
(時間の目安)9時30分、10時、10時30分、11時、11時30分
D 治験届提出
(30分毎×窓口数1)5枠
(時間の目安)9時30分、10時、10時30分、11時、11時30分
(2)窓口に来られる担当者の情報を記載してください。備考欄には企業名・所属部署を記入し、可能ならば「申請・届出の別/申請等の種類」「持ち込み件数」など、事前に持ち込む書類の情報もお知らせください。
ただし、品目名など機微情報は絶対に記入しないでください。
(3)予約が完了すると、登録されたメールアドレスに予約完了通知が送信されます。予約完了通知は印刷して、予約当日、窓口に提示してください。
予約した時間の10分前になったら、6階待合室のタッチパネルを操作して番号札をお取りください。 (予約時間は確保されていますので、番号札を早めに取らないようにご協力をお願いします。)
2.予約についてのお願い
- 予約は1日1社1回とし、1社で複数回を予約するようなことがないようにお願いします
- 予約した時間を5分経過しても来訪されない場合は、キャンセルされたものと判断します
- 治験届・輸出証明書発給申請を除き、窓口で受付する件数は1社5件以内でお願いします(5件を超える持ち込みの場合は、受取のみとさせていただきます)
- 年末年始の受付予約について
受付窓口の最終日は12月28日(休日の場合前営業日)、初日は1月4日(休日の場合翌営業日)です
1月4日(休日の場合翌営業日)の属する週の予約受付は、12月23日(休日の場合翌営業日)の10時から予約日前日の14時までとします(変更がある場合には、本ページでお知らせを掲載いたします)
3.窓口にお越し頂く方へのお願い
(1)窓口受付は申請書類等の受付のみを行います。
窓口でのご相談はお引き受けできません。ご相談はメールでの問い合わせをご活用ください。
(2)承認書・認定証・登録証・証明書につきましては、郵送での受け渡しにご協力をお願いします。
詳しくは、「4.承認書等の交付について」をご参照ください。
(3)体調不良の方のご来訪はご遠慮願います。また、できるだけ複数人でのご来訪はご遠慮願います。
(4)筆記用具等の貸し出しはいたしません。収入印紙等は事前に申請書類等に貼付をお願いします。
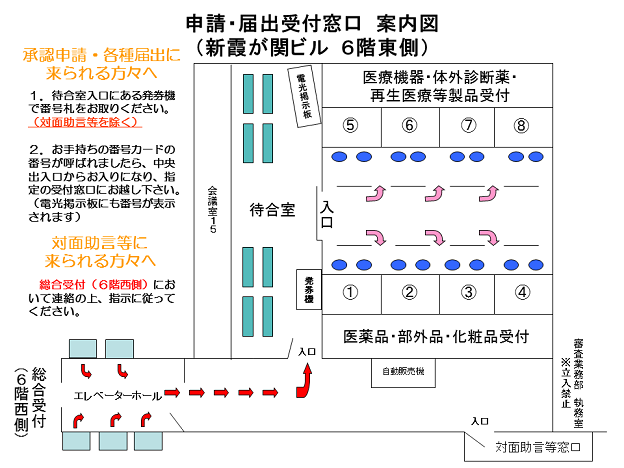
- 申請・届出受付窓口 6階案内図[112KB]
- 対面助言係る資料の提出等については、本受付窓口ではございません
<問い合わせについて>
医薬品医療機器法に基づく各種申請・届出等に関する記述方法や手続きについてのご質問は、的確にお答えするため電子メールにてのみお受けしております。
所定の問合せ票に記載の上、各担当部署宛てにメールでお問い合わせください。
迷惑メール防止対策をしているため、送信の際は[at]を半角のアットマークに置き換えてください。
(注意)この窓口で回答できる内容は限られます。申請・届出等に関する問い合わせについての注意事項など、必ず事前にこちらをご覧下さい。
| 機構担当部署 | お問い合わせ先 |
|---|---|
| 審査業務部業務第一課 (医薬品・医薬部外品・化粧品) |
iyaku-tetsuzuki[at]pmda.go.jp 申請窓口への問合せ票 (ワードファイル)[28.5KB] |
| 審査業務部業務第二課 (医療機器・体外診断用医薬品・再生医療等製品) |
kiki-tetsuzuki[at]pmda.go.jp 申請窓口への問合せ票 (ワードファイル)[28.5KB] |
| 審査マネジメント部 マスターファイル管理室(MF) |
mf-tetsuzuki[at]pmda.go.jp MFに関する問合せ票 (ワードファイル)[20.2KB] |
| 審査マネジメント部 審査企画課 (治験計画届書等) |
「治験届及び治験副作用/不具合等報告等の提出に関する問合せ(治験依頼者等向け)」のページをご覧ください。 |
メールアドレスの受信サイズ上限は10MBとなっております。
添付ファイルが9MBを超える場合には、届かない可能性がございますのでご注意ください。
添付ファイルを分割するなどして、省サイズ化していただきますよう、お願いいたします。
申請予告について
ゲートウェイシステムは申請予告をお願いします。
eCTD及び再審査申請については、電子メールにて事前に連絡をお願いします。2022年4月以降の申請に関しては、eCTDの種別についても必ずご記載ください。
<申請予告先メールアドレス>
メールアドレス(業務第一課): iyaku-uketsuke[at]pmda.go.jp
メールアドレス(業務第二課)(再生医療等製品のeCTDの申請予告):kiki-uketsuke[at]pmda.go.jp
迷惑メール防止対策をしているため、送信の際は[at]を半角のアットマークに置き換えてください。
通常の電子メールであり、情報漏洩防止に有効とされる暗号化等は行っていません。
機構のセキュリティ上の理由から、一定の条件に該当するメールは排除される可能性があります。上記メールアドレスへ初めて送信される際は、送信後お電話にて到達確認をされることを推奨致します。
また、「送信メールに添付したファイルがクラウドサーバーにアップロードされ、受信者は指定URLからダウンロードする」
といった企業のセキュリティ対策メールシステムを導入されている場合は、事前に申請予告先メールアドレスへ連絡してください。事前連絡が無いと、当日添付したファイルが確認できない場合がございます。
承認書等の交付について
基本的に、承認書・認定証・登録証・証明書は郵送での受け渡しにご協力をお願いします。
<郵送による承認書等交付の場合>
- 郵送による交付を希望される場合、申請時又は差換え時に、申請書類と共に承認書等返送用の封筒(信書便)をご提出ください。交付の準備が整いましたら、返送用封筒にて送付いたします。
- ただし、オンライン提出の場合には、返送用封筒の提出タイミングが申請の種類毎に定められております。最新の「申請書等のオンライン提出に係る取扱い等について」厚生労働省医薬・生活衛生局四課長連名通知[2.65MB]で必ずご確認ください。
<承認書等返送用封筒の注意点>
- 「承認書等在中」の旨を明記し、できるだけ1申請に1封筒をご用意ください
- 重要書類のため、封筒はレターパックライト/プラス等の信書便や書留など、配達の記録が残る郵送の返送方法を推奨いたします
- 提出時の「受付控え」の時とは違い、個人宅へ「承認書等」の送付はできません。テレワークのため個人宅へ承認書の郵送を希望する、といった場合でも対応できませんので、封筒には法人住所を記載するようにお願いいたします。
<受付窓口で交付できる承認書等>
- 「製造販売承認書・製造販売承認事項一部変更承認書」(一部除く)
- 「外国製造業者認定証・登録証」
- 上記の申請に関する取下げ願提出による申請書等の返却
- 「各種 証明書」
<受付窓口での交付の場合>
- 交付の準備が整いましたら、担当者より電話にてご連絡いたします
<当日の交付について>
- 承認書等の内容をご確認いただき、交付となります
- 13時30分から14時30分の時間帯で対応いたします
- 申請者と証明できるもの(名刺・社員証等)をご持参ください
申請・届出等に関する参考通知等・周知事項
上記以外の各種通知についてご案内いたします。
<通知> 独立行政法人医薬品医療機器総合機構が行う審査等業務に係る申請・届出等の受付等業務の取扱いについて(2022年(令和4年)12月26日薬機発第1226041号)[399KB]
<通知> 医療機器WEB申請プラットフォームの取扱いについて(2022年(令和4年)12月26日付け薬機発第1226043号)[274KB]
<通知> オンラインによる申請書・届書の提出について(2022年(令和4年)12月26日付け事務連絡)[281KB]
<通知> 医薬品新添加物の審査資料の提出について(2017年(平成29年)6月23日医薬品医療機器総合機構通知)[107KB]
<通知> 審査等業務に係る申請・届出等の受付窓口の予約制移行について(2020年(令和2年)7月27日薬機発第0727039号)[120KB]
<通知> 審査等業務に係る申請・届出等の受付窓口の再開について(2022年(令和4年)3月22日薬機発第0322011号)[92.3KB]
- 2020年12月25日から申請書や届書等への押印が不要となりました。
<厚労省通知> 新医療用医薬品に関する安全性定期報告制度について(2020年(令和2年)8月31日薬生発0831第5号)[151KB]
承認申請資料等の荷物搬入・駐車についてのお知らせ
承認申請資料等の搬入時の駐車場所等につきまして次のようにご案内申し上げますので、皆様のご理解とご協力を賜りますようよろしくお願いいたします。
詳細については、新霞が関ビル 時間貸し駐車場運営会社のウェブサイトをご確認ください。
承認申請資料等の荷物を自動車で搬入される場合
車両制限
高さ2m、長さ5m、幅1.9m、重量2t以内の自動車に限られます。
駐車料金
30分単位で300円ずつ加算されます。
荷下ろし
地下1階駐車場の空いたスペースに車を止めていただき、荷下ろしをお願いいたします。
荷物の運搬
荷物運搬には専用エレベーターをご利用願います。
大量の資料のために車両制限を超えるような大型自動車(但し、2.7m以下の車)で搬入される場合
新霞が関ビル1階(高速側(六本木通り側))の大型車駐車スペースに止めることが可能です。
その際には、新霞が関ビル管理事務所の許可・予約が必要となりますので、
事前(数日前)に「行先部署名、日時、車両番号、車高、使用業者名等」を審査業務部 業務第一課あて電子メールへお申し出ください。
連絡先
担当部署
審査業務部 業務第一課
電話
03-3506-9437
メールアドレス
iyaku-uketsuke[at]pmda.go.jp
迷惑メール防止対策をしているため、送信の際は[at]を半角のアットマークに置き換えてください。
