お知らせ
外国製造業者認定等の申請等に必要な書類・提出部数・様式・記入見本については、こちらのページをご参照ください。
目次
認定とは
外国において日本に輸出される医薬品又は医薬部外品を製造しようとする者を、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下「医薬品医療機器法」という。)における医薬品等外国製造業者といい、国内製造業者の許可と同様に、外国製造業者が医薬品医療機器法第13条の3による認定を受けていることが当該医薬品等の製造販売承認の要件となっています。(認定は、区分に従って、製造所ごとに与えられます。) 外国製造業者の認定は、有効期間である5年ごとにその更新を受けなければ、その期間の経過によって、その効力を失います。
また、日本に輸出される原薬のみを製造する外国製造業者も認定が必要です。ただし、2005年(平成17年)4月1日の時点で、日本に輸出されている医薬品等の外国製造業者から当該品目を輸入する旧薬事法の輸入販売業者の許可の残存期間中は、当該外国製造業者について認定を受けたものとみなされます。
外国製造業者の認定権者は厚生労働大臣であり、認定のための外国製造所の構造設備の調査は機構が行います。
1-2. 登録とは
外国において日本に輸出される医薬品又は医薬部外品を製造しようとする者を、医薬品医療機器法における医薬品等外国製造業者といい、国内製造業者の許可と同様に、外国製造業者が医薬品医療機器法第13条の3による認定を受けていることが当該医薬品等の製造販売承認の要件となっていましたが、医薬品医療機器法の一部を改正する法律(2019年(令和元年)法律第63号)により、製造工程のうち保管のみを行う製造所は、厚生労働大臣の登録を受けたときには認定を受けることを要しないこととされました。
登録によって行うことができない保管や手続きの詳細については、下記通知をご確認ください。
- 2021年(令和3年)4月28日 薬生薬審発0428第2号 厚生労働省医薬・生活衛生局医薬品審査管理課長通知「医薬品等の保管のみを行う製造所の取扱い等について」[310KB]
- 2021年(令和3年)7月2日 事務連絡「医薬品等の保管のみを行う製造所に関する質疑応答集(Q&A)について」[190KB]
参考資料
製薬企業等の研究開発や薬事担当者向けの研修資料「医薬品承認申請実務担当者向け資料」がございます。外国製造業者認定・登録についてもまとめておりますので、参考までにご一読ください。
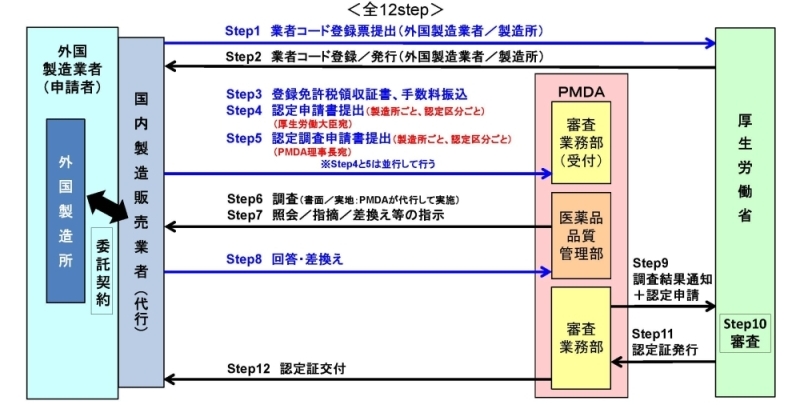
申請等手続きについて(手順)
(「登録申請」については、「認定」を「登録」に読み替えてください)
 [130KB]
[130KB]
Step1,2【業者コード登録】
- 認定申請に先立ち、当該外国製造業者及び製造所の業者コードの登録が必要です。登録先窓口は厚生労働省です。
- 詳しくは、厚生労働省のFD申請についてのHP内<e-Govを利用した業者コード登録マニュアル.pdf>を参照してください。厚生労働省からの詳しい通知内容については、以下PDFの「1 業者コードの登録について」をご一読ください。
厚生労働省のFD申請についてのHPURL:https://web.fd-shinsei.mhlw.go.jp/notice/index.html
厚生労働省医薬・生活衛生局医薬品審査管理課長通知 「医薬品等の製造業許可事務等の取扱いについて」(2021年(令和3年)4月26日、薬生薬審0426第7号)[468KB]
(ファクシミリ向けのWord/PDF)通知内の様式ダウンロードはこちらのページの一番下をご参照ください
Step3【登録免許税領収書・手数料振込】
- 国への手数料と、PMDAへの調査手数料が必要です。金額については、以下の表や、「医薬品等外国製造業者の認定・登録に必要な書類」の各申請の「申請等に必要な書類」の表に記載しております。
(例:新規認定の場合 国手数料:登録免許税 90,000円 PMDA手数料:調査手数料 62,600円)
| 申請等の種類 | 国手数料 | PMDA調査手数料(銀行振込) | |
|---|---|---|---|
| 認定 | 新規認定 | 登録免許税 90,000円 | 62,600円 |
| 区分追加 | 登録免許税 90,000円 | 42,900円 | |
| 区分変更 | 収入印紙 23,400円 | 42,900円 | |
| 認定更新 | 収入印紙 23,400円 | 42,900円 | |
| 書換え交付/再交付 | 収入印紙 19,700円 | 不要 | |
| 変更届/廃止届 | 不要 | 不要 | |
| 登録 | 新規登録 | 登録免許税 90,000円 | 不要 |
| 登録更新 | 収入印紙 23,400円 | 不要 | |
| 書換え交付/再交付 | 収入印紙 19,700円 | 不要 | |
| 変更届/廃止届 | 不要 | 不要 | |
- 登録免許税の納付方法については、「審査等手数料・対面助言等の手数料について」のページや、【登録免許税の納付方法について[19.1KB]】をご確認ください。登録免許税は、e-Tax・インターネットバンキング・クレジットカード納付・コンビニ納付等を利用できません。必ず各税務署等での窓口納付をご利用ください。
- PMDA手数料の振込先・手数料コードについては、「審査等手数料・対面助言等の手数料について」のページで確認して下さい。
- PMDA手数料の「外国製造業認定等申請に係る調査手数料振込みについてのお願い[559KB]」をまとめております。複数の申請の手数料を一括で振込する場合には、内訳の作成をお願いします。
- 申請時の提出方法は、国手数料:登録免許税「認定申請書正本1枚目の裏面に領収証書(原本)を貼付」、収入印紙「認定申請書正本の上部余白に収入印紙を貼付」、PMDA手数料:調査手数料「調査申請書裏面に振込金受領書(写)を貼付」となっております。
- 機構に対する認定調査申請手数料は、実地調査か書面調査かによって、その金額が異なりますが、原則として、外国製造業者認定に係る外国製造所の構造設備調査のためだけに実地調査を行うことは予定していませんので、調査申請に際しては書面調査の手数料の振り込みをお願いしております。
注意:調査申請書の裏面に貼付する振込金受取書等の写しについて
銀行等の振込明細がA4サイズなどで印刷され、申請書裏面の貼付欄に貼り付けできない場合には、調査申請書にクリップで留めてご提出ください。(ホチキスでは留めないでください)
紙を二つ折りにして裏面に貼り付ける方法は、紙が破けるなどの危険性がございますので、避けていただきますようお願いいたします。
貼付欄に貼り付けできないうえ、A4サイズより小さな紙の写しの場合には、A4サイズの紙に貼り付けたうえで、調査申請書にクリップで留めてください。
Step4,5【申請書等の作成・提出】
- 申請書・届書のデータ作成・FD申請データ作成のため、厚生労働省で配布している【医薬品医療機器等法対応電子申請ソフト】をPCにインストールしてご利用ください。
厚生労働省医薬品医療機器等法対応電子申請ソフトのダウンロード・マニュアルのダウンロード
URL:https://web.fd-shinsei.mhlw.go.jp/download/software/
詳しい操作方法については、必ずマニュアルを見ながら確認してください。
- この【医薬品医療機器等法対応電子申請ソフト】で作成するものは、認定申請書や変更届書などの申請書です。「医薬品等外国製造業者の認定・登録に必要な書類」の各申請の「必要な書類」の表の備考欄に、「FDデータを打ち出した書類も併せて提出」とあるものは、すべてこのソフトで作成します。
- 外字について入力が必要な場合には、【外字を使用する場合について[610KB]】をご一読ください。外字の作成から、外字対応表のFD申請ソフトへの登録方法まで解説しております。
- 郵送又は受付窓口による提出の場合、紙媒体で提出するほか、作成したFD申請データも所定の手順で出力し、ZIPファイルで保存したものをCD-Rなどの光学メディアに入れてください。
申請書等の提出先窓口や提出方法については、「受付業務について」のページでご確認ください。
- オンライン提出の場合、紙媒体や光学メディアではなく申請電子データシステム(ゲートウェイシステム)を利用して電子ファイルの提出を行います。(収入印紙や封筒の郵送は必要です)
オンライン提出を行うためには、事前にゲートウェイシステムへのユーザー登録や電子証明書(有料)の取得が必要です。詳しくはゲートウェイシステムの操作マニュアルをご確認ください。
申請電子データシステム(ゲートウェイシステム) URL:https://esg.pmda.go.jp/Ssk/comn001p01.init
申請電子データシステム操作マニュアルURL:https://esg.pmda.go.jp/files/manual.html
- 申請における留意事項については「申請等の手続き」のページ及び、同ページ内の「関連通知」をご確認ください。特に、関連通知にございます「申請書等のオンライン提出に係る取扱い等について」厚生労働省医薬・生活衛生局四課長連名通知[2.65MB]の別添「2.全体的な留意事項」及び「4.業許可等の申請等」には、オンライン提出における収入印紙や封筒の提出方法等が記載されておりますので、必ずご確認ください。
Step6,7,8【申請書の差換え】
PMDAより差換えの指示があった場合には、電子申請ソフトを「差換えモード」に切り替えて、書類の作成を行ってください。正本、副本合わせて2部が必要です。
Step9,10,11,12【認定証の交付】
すべての手続きが無事に完了いたしましたら、認定証を交付いたします。
認定に必要な標準的事務処理期間としては明記されたものはありませんが、国内の大臣許可製造所に対する許可について、 申請から許可までの事務処理期間の目安を概ね5か月程度としていることから、外国製造業者の認定についても、申請から5か月程度を目安として下さい。登録の場合、申請から2か月程度を目安として下さい。
なお、新規に認定を取得する場合であって、1つの認定申請で同時に2つ以上の区分を申請することはできません。2つ以上の区分を希望する場合は、認定申請と同時に、1区分毎に認定区分追加申請を提出して下さい。
申請等の種類について(必要な書類)
(「登録申請」については、「認定」を「登録」に読み替えてください)
申請等の種類
| 種類 | 説明 |
|---|---|
| 認定申請 | 外国製造業者の新規の認定申請です。 この申請で申請できる区分は1つまでです。2つ以上の区分を希望する場合は、次項の追加申請を行います。 |
| 認定区分 変更申請 /追加申請 |
認定区分変更申請は、既に認定された区分を廃止すると同時に、新しい区分の認定を追加するための申請です。 認定区分追加申請は、認定を取得したあと、もしくは同時に、他の認定区分を追加する場合に行います。 両申請ともに、新しく追加できる区分は、1申請につき1区分までです。 (注)登録において、区分変更/追加はありません。 |
| 認定更新 申請 |
外国製造業者の認定は、有効期間である5年ごとにその更新を受けなければ、その期間の経過によって、その効力を失います。 更新の申請時期については、有効期限から極端に早い時期に申請されますと、認定がおりるまでの間に申請内容に変更が生じる可能性がありますので、有効期限の5か月前を目処に申請していただくようお願いいたします(注1)。登録の場合は、有効期限の2か月前を目処に申請していただくようお願いいたします。 申請前に全ての変更届書を提出しているかどうかを再確認し、届出漏れがある場合は、すぐに変更届書を提出して下さい。 (注1)有効期間が終了する間際に更新申請書が提出され、 有効期間内に更新手続きが完了しないケースが認められています。下記ホームページで公表している「認定・登録外 国製造業者リスト」において、有効期間が終了する5ヶ月前を過ぎても更新申請書が提出されていない外国製造業者は黄色で色づけしているのでご確認ください。 外国製造業者認定・登録番号の公表 | 独立行政法人 医薬品医療機器総合機構 (pmda.go.jp) 有効期限を超過してから申請する場合には、まず厚生労働省医薬品審査管理課へご相談ください。 |
| 書換え交付 申請 /再交付 申請 |
外国製造業者認定証の記載事項に変更を生じたときは、書換え交付を申請することができます。 許可証を破り・汚し又は失ったときは、その再交付を申請することができます。 |
| 変更届書 (医薬品医療機器法施行規則第100条) |
変更届書は、変更の日(変更年月日)毎に提出してください。異なる変更年月日を一つの届出として、まとめて提出することはできません。 次の事項を変更したときは変更の日から30日以内に、医薬品医療機器法施行規則の様式第6による変更届書を厚生労働大臣宛てに届け出なければなりません。(注1)(届出の窓口は機構です。)
製造所の所在地で、単なる「住居表示の変更」があった場合のみ、変更届書で所在地を変更することができます。(移転等により所在地が変更になった場合は、新しく認定を取得する必要があります) (注1)変更後30日後から1年以内の場合は、遅延の理由書を出していただきます。1年を超過する場合には、まず厚生労働省医薬品審査管理課へご相談ください。 (注2)登録において、構造設備は登録事項でないため、構造設備の主要部分に係る変更を届け出る必要はありません。 業者コードに関する留意事項 業者コード登録事項に変更があった場合、変更届の提出とあわせて業者コード登録の変更申請を行うことが必要です。(業者コード登録については上記Step1.2業者コード登録を参照) |
| 廃止届 (医薬品医療機器法施行規則第18条) |
認定の有効期間内に、日本向けの全ての原薬や製剤の製造を止め、今後も製造を行わない場合は、廃止の届出を行う必要があります。 なお、有効期間満了をもって廃止する場合は、廃止届は不要です。 |
外国製造業者認定等の申請等に必要な書類
外国製造業者認定等の申請等に必要な書類・提出部数・様式・記入見本については、こちらのページをご参照ください。
通知による留意事項の一部紹介
以下の通知より、留意事項を紹介いたします。
- 厚生労働省医薬食品局 審査管理課長通知「医薬部外品及び化粧品の外国製造業者の範囲について」2005年(平成17年)3月31日 薬食審査発第0331018号[1.11MB]
- 厚生労働省医薬・生活衛生局医薬品審査管理課長通知「医薬品及び医薬部外品に関する外国製造業者の認定及び登録申請等の取扱いについて」2021年(令和3年)4月28日 薬生薬審発0428第4号[214KB]
A.医薬部外品に係る外国製造業者認定等に関する留意事項
(1) 必要な書類の添付書類として定められている「製造所の責任者の履歴書」については、当該外国製造業者の製造する医薬部外品の製造販売業者の責任において担保する場合に限り、添付不要とすることができる。
この場合において、医薬品医療機器法施行規則様式第18の外国製造業者認定申請書、同第20外国製造業者認定更新申請書、同第21の2外国製造業者登録申請書又は同第21の4外国製造業者登録更新申請書(以下「外国製造業者認定申請書等」という。)の「製造所の責任者」欄中「住所」欄及び「申請者の欠格条項」欄の記載や、規則様式第6の変更届書中「変更内容」欄への「製造所の責任者」の「住所」及び「申請者の欠格条項」の記載を省略して差し支えない。代わりに、添付書類として当該外国製造業者の製造する医薬部外品の製造販売業者の「担保を宣誓する書類」を提出すること。
「担保を宣誓する書類」の例として、以下の旨を記載するとよい。
- x月x日付申請の「(申請内容)」に係る当該製造所の責任者の履歴について、製造販売業者の責任において担保すること
- 2021年(令和3年)4月28日付薬生薬審発0428第4号通知に基づき、規則第36条第3項第1号(又は第37条の2第3項第1号)に定める製造所の責任者の履歴書を省略すること
- 申請者の住所・氏名
- 担保する事項(製造所の責任者の履歴)
- 省略した添付書類(製造所の責任者の履歴書)
- 宛名「厚生労働省 医薬局医薬品審査管理課長 殿」
- 提出者の住所・氏名
(2) 外国製造業者認定申請書等の「その他備考」欄に、医薬品医療機器法施行令第20条第2項に規定する医薬部外品及び殺虫剤又は殺そ剤たる医薬部外品は「GMP対象医薬部外品」、それ以外の医薬部外品は「GMP対象外医薬部外品」と記載すること。
- 「GMP対象外医薬部外品」は、医薬部外品の製造工程を行う(包装、表示又は保管のみを行うものを除く。)製造所のうち、最終の製造工程を行う製造所の認定が必要。
- 「GMP対象医薬部外品」は、原薬の製造工程以降の全ての製造所(包装、表示又は保管のみ製造所を含む)で認定が必要。
B.企業の吸収合併等の認定申請
企業の吸収合併等により既に認定等を受けた外国製造業者が新たに認定等を取得する必要がある場合の認定等申請については、以下に基づき認定等手続を通常の手続より迅速に行うこととする。
(1) 認定等手続を迅速に行う範囲
以下の条件を満たす場合とする。
ア 新たに認定等を取得しなければならない製造所が、当該吸収合併等の前の段階で、既に外国製造業者の認定等を受けている製造所であること。
イ 既に認定等を受けた製造所の所在地、認定区分及び構造設備と同一であること。
(2) 認定等申請書の記載について
申請書の鑑の右肩に、丸と丸内に「M」と朱書きするとともに、「その他備考」欄に「2021年(令和3年)4月28日付け薬生薬審発0428第4号通知による認定等申請」と記載すること。
(3) 認定等の申請書及び添付すべき資料について
通常の外国製造業者の認定等申請と同様の申請書及び添付資料を提出すること。
申請等にかかわる参考通知等
(参考通知や質疑応答集(Q&A)の一覧についてはこちらのページをご参照ください)
<通知> 外国製造業者認定・登録に関連する通知等について
- 厚生労働省医薬・生活衛生局医薬品審査管理課長通知「医薬品及び医薬部外品に関する外国製造業者の認定及び登録申請等の取扱いについて」2021年(令和3年)4月28日 薬生薬審発0428第4号[214KB]
- 厚生労働省医薬・生活衛生局 医薬品審査管理課長通知「医薬品・医薬部外品外国製造業者認定の更新・廃止等の手続きについて」2016年(平成28年)3月30日 薬生審査発0330第4号[125KB]
<通知> 申請手続き実施要綱について
<通知> 製造工程のうち保管のみを行う製造所について
医薬品医療機器法の一部を改正する法律により、医薬品、医薬部外品及び化粧品の外国製造業者に関し、製造工程のうち保管のみを行う製造所は、厚生労働大臣の登録を受けたときには認定を受けることを要しないこととされました。
- 厚生労働省医薬・生活衛生局医薬品審査管理課長通知「医薬品等の保管のみを行う製造所の取扱い等について」2021年(令和3年)4月28日 薬生薬審発0428第2号[310KB]
- 「医薬品等の保管のみを行う製造所に関する質疑応答集(Q&A)について」2021年(令和3年)7月2日 事務連絡[190KB]
申請等に関する問い合わせ先
- 申請窓口への問い合わせ(審査業務部 業務第一課)
医薬品、医薬部外品に関する申請・届出等の手続きについてのご質問方法はこちらのページをご参照ください - 申請に係る構造設備調査についての問い合わせ(医薬品品質管理部)
電話番号:03-3506-9446
