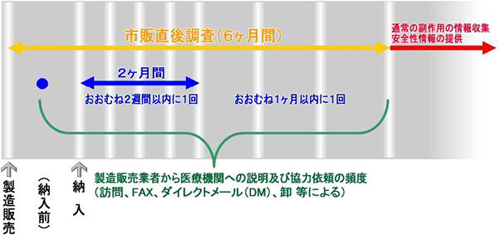
新医薬品がいったん販売開始されると、治験時に比べてその使用患者数が急激に増加するとともに、使用患者の状況も治験時に比べて多様化することから、治験段階では判明していなかった重篤な副作用等が発現することがあります。このように新医薬品の特性に応じ、販売開始から6か月間について、特に注意深い使用を促し、重篤な副作用が発生した場合の情報収集体制を強化する市販直後調査は、市販後安全対策の中でも特に重要な制度であります。
現在実施中の市販直後調査についての情報を提供いたします。
市販直後調査の詳細については下記通知及び安全性情報170号(2001年9月)安全性情報212号(2005年4月)をご覧下さい。
| 通知番号等 | 表題 |
|---|---|
| 2022年5月31日 事務連絡 |
医療用医薬品の市販直後調査に関するQ&Aについて[267.55KB] |
| 2022年5月31日 薬生安発0531第1号 |
医療用医薬品の市販直後調査の実施方法等について[141.67KB] |
自ら所属する医療機関、薬局等において使用することを目的とする場合を除き、本情報の内容を情報提供者に無断で複製、転載、頒布する等の行為を禁じます。
市販直後調査の対象品目一覧(2025年12月末日現在)
| 一般名 | 販売名 (製造販売業者、添付文書、審査報告書等を閲覧できるページに遷移します) |
市販直後 調査開始 年月日 |
効能追加等における対象 |
|---|---|---|---|
| ジアゼパム | スピジア点鼻液5mg,同点鼻液7.5mg,同点鼻液10mg | 2025年12月24日 | |
| フィネレノン | ケレンディア錠10mg,同錠20mg | 2025年12月22日 | 慢性心不全 ただし,慢性心不全の標準的な治療を受けている患者に限る |
| オデビキシバット水和物 | ビルベイ顆粒200μg,同顆粒600μg | 2025年12月18日 | |
| リメゲパント硫酸塩水和物 | ナルティークOD錠75mg | 2025年12月16日 | |
| ミダゾラム | ドルミカムシロップ2mg/mL | 2025年11月27日 | |
| アバシンカプタド ペゴルナトリウム | アイザベイ硝子体内注射液20mg/mL | 2025年11月27日 | |
| ボルノレキサント水和物 | ボルズィ錠2.5mg,同錠5mg,同錠10mg | 2025年11月27日 | |
| ケノデオキシコール酸 | フジケノン粒状錠125 | 2025年11月21日 | 脳腱黄色腫症 |
| ベムペド酸 | ネクセトール錠180mg | 2025年11月21日 | |
| レポトレクチニブ | オータイロカプセル40mg,同カプセル160mg | 2025年11月20日 | NTRK融合遺伝子陽性の進行・再発の固形癌 |
| イネビリズマブ(遺伝子組換え) | ユプリズナ点滴静注100mg | 2025年11月20日 | IgG4関連疾患の再燃抑制 |
| ゴゼトチド | ロカメッツキット | 2025年11月12日 | |
| ルテチウムビピボチドテトラキセタン(177Lu) | プルヴィクト静注 | 2025年11月12日 | |
| タレトレクチニブアジピン酸塩 | イブトロジーカプセル200mg | 2025年11月12日 | |
| ゾンゲルチニブ | ヘルネクシオス錠60mg | 2025年11月12日 | |
| ヌシネルセンナトリウム | スピンラザ髄注28mg,同髄注50mg | 2025年11月12日 | |
| セルメチニブ硫酸塩 | コセルゴ顆粒5mg,同顆粒7.5mg | 2025年11月12日 | |
| ニポカリマブ(遺伝子組換え) | アイマービー点滴静注1200mg | 2025年11月12日 | |
| パロペグテリパラチド | ヨビパス皮下注168μgペン,同皮下注294μgペン,同皮下注420μgペン | 2025年11月6日 | |
| 塩化ガリウム(68Ga) | ガリアファーム68Ge/68Gaジェネレータ | 2025年11月5日 | |
| レミマゾラムベシル酸塩 | アネレム静注用20mg | 2025年11月4日 | 消化器内視鏡診療時の鎮静 |
| 21価肺炎球菌結合型ワクチン(無毒性変異ジフテリア毒素結合体) | キャップバックス筋注シリンジ | 2025年10月29日 | |
| セペタプロスト | セタネオ点眼液0.002% | 2025年10月23日 | |
| コロナウイルス(SARS-CoV-2)RNAワクチン | ダイチロナ筋注 | 2025年9月19日 | |
| エトラシモド L-アルギニン | ベルスピティ錠2mg | 2025年9月12日 | |
| ミグルスタット | オプフォルダカプセル65mg | 2025年8月27日 | 遅発型ポンペ病に対するシパグルコシダーゼ アルファ(遺伝子組換え)との併用療法 |
| シパグルコシダーゼ アルファ(遺伝子組換え) | ポムビリティ点滴静注用105mg | 2025年8月27日 | |
| 組換え沈降9価ヒトパピローマウイルス様粒子ワクチン(酵母由来) | シルガード9水性懸濁筋注シリンジ | 2025年8月25日 | ヒトパピローマウイルス6,11,16,18,31,33,45,52及び58型の感染に起因する以下の疾患の予防 ・肛門癌(扁平上皮癌)及びその前駆病変(肛門上皮内腫瘍(AIN)1,2及び3) |
| セルメチニブ硫酸塩 | コセルゴカプセル10mg,同カプセル25mg | 2025年8月25日 | |
| アバトロンボパグマレイン酸塩 | ドプテレット錠20mg | 2025年8月25日 | 持続性及び慢性免疫性血小板減少症 |
| ベルズチファン | ウェリレグ錠40mg | 2025年8月18日 | |
| ソタテルセプト(遺伝子組換え) | エアウィン皮下注用45mg,同皮下注用60mg | 2025年8月18日 | |
| トアルクエタマブ(遺伝子組換え) | タービー皮下注3mg,同皮下注40mg | 2025年8月14日 | |
| エルダフィチニブ | バルバーサ錠3mg,同錠4mg,同錠5mg | 2025年7月16日 | |
| チスレリズマブ(遺伝子組換え) | テビムブラ点滴静注100mg | 2025年7月1日 |
