カルタヘナ法に係る申請等の概要
医薬品等分野におけるカルタヘナ法の概要
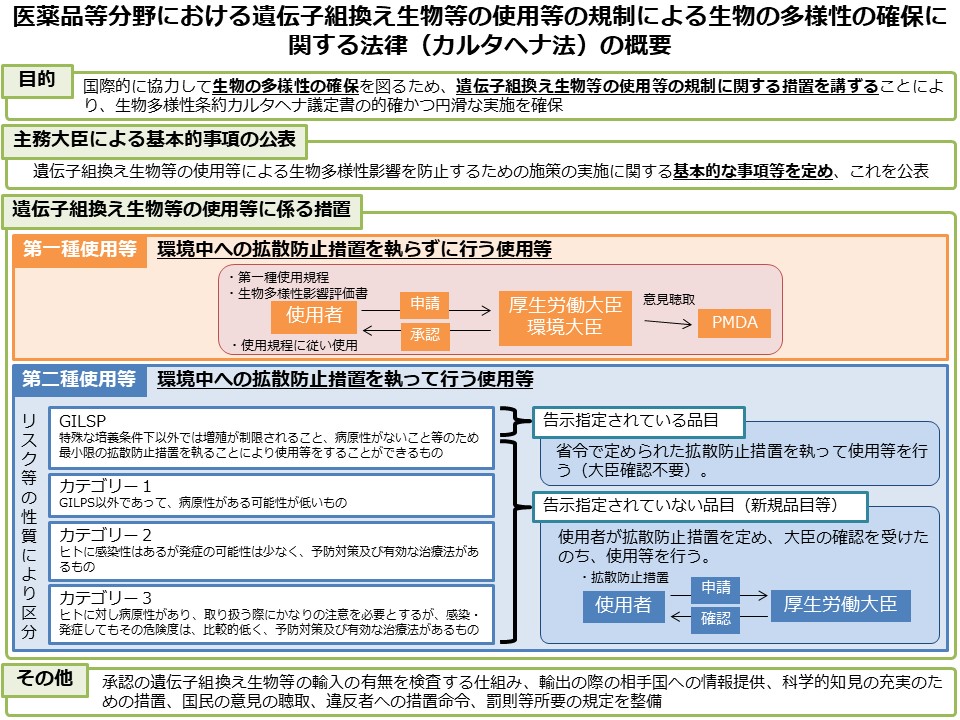
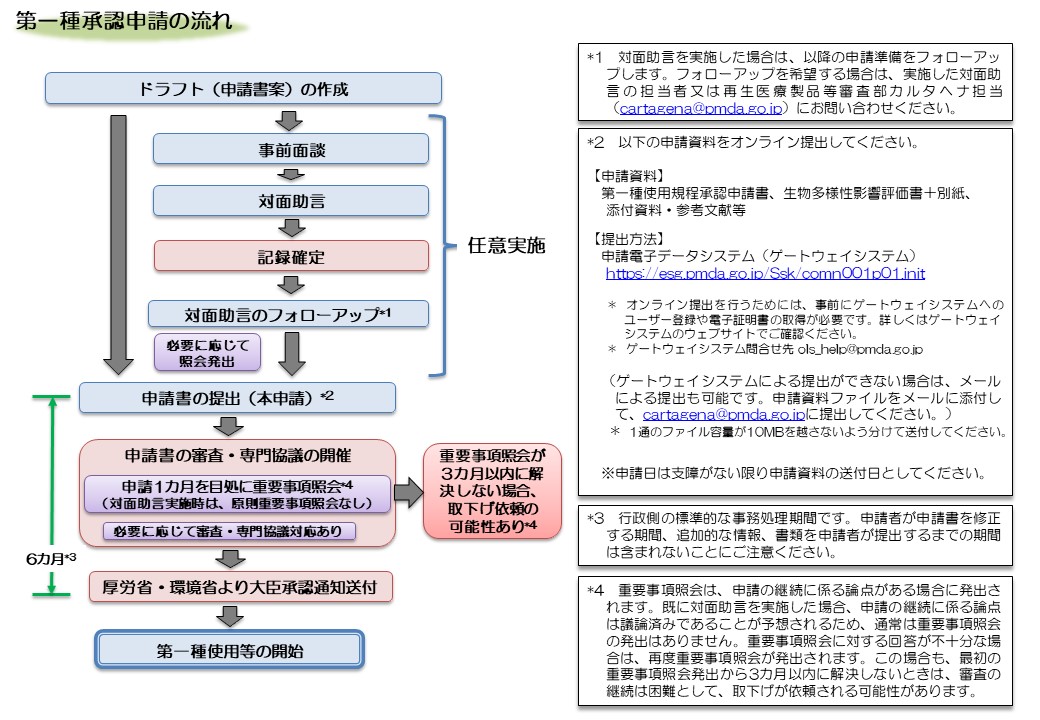
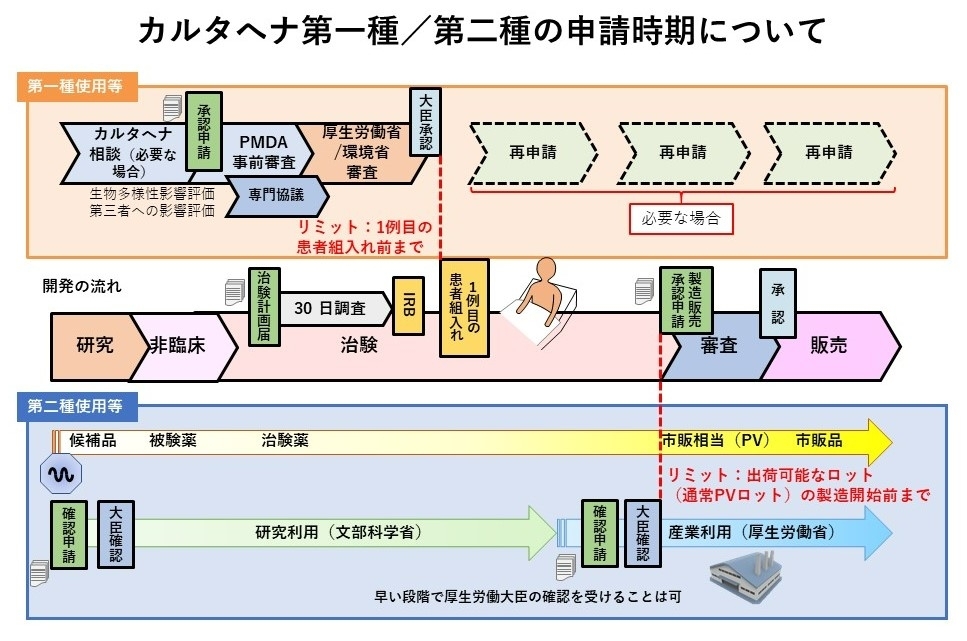
- 遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)に基づき、第一種使用等(法第2条第6項の拡散防止措置を執らないで行う使用等)を行おうとする場合は、主務大臣(厚生労働大臣及び環境大臣)の承認が必要です。
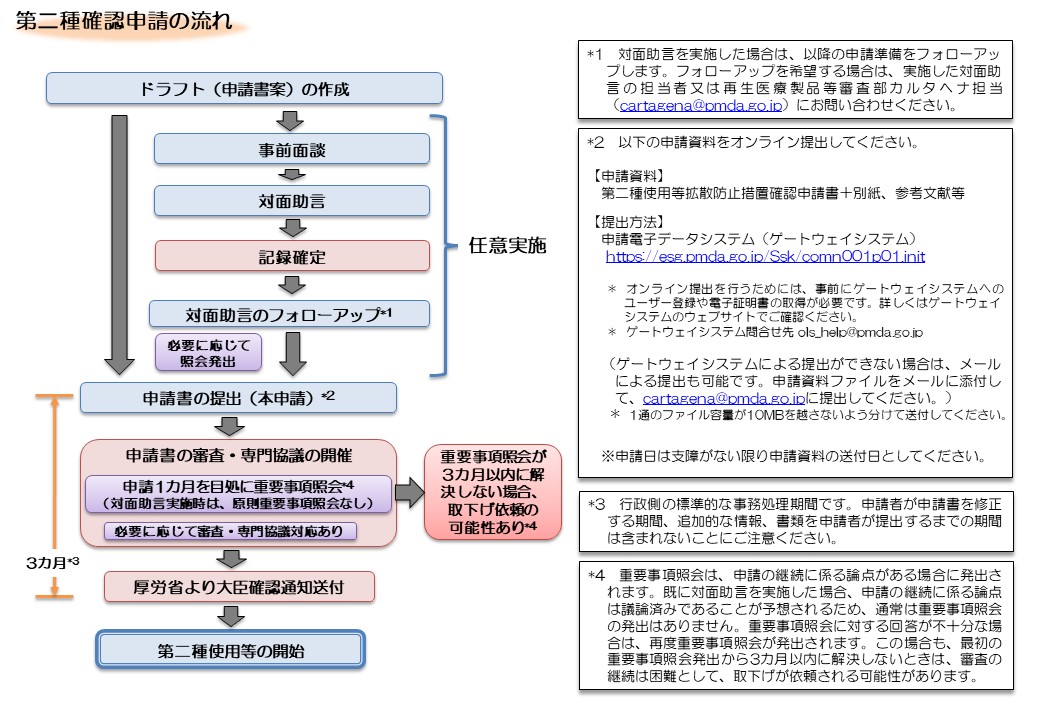
- また、産業利用上の第二種使用等(法第2条第6項に示されている、施設、設備その他の構造物の外の大気、水又は土壌中への遺伝子組換え生物等の拡散を防止する意図をもって行う使用等)を行おうとする場合は、主務大臣(厚生労働大臣)の確認が必要です(ただし、運搬や保管のみの場合、GILSP告示に定められたGILSP遺伝子組換え微生物の使用等を除きます)。
- PMDAでは、医薬品分野における第一種使用等の承認と第二種使用等の確認に関する審査等を行っています。
医薬品等分野におけるカルタへナ法に基づく第一種/第二種の申請時期について
医薬品等分野におけるカルタへナ法に基づく申請等に関する相談について
- 2019年度より、カルタヘナ法に基づく申請等に関する相談(対面助言・事前面談)を行っています。
- カルタへナ法関連相談事前面談では、対面助言実施に当たっての論点整理・資料整備や、申請内容に関するご質問を承っております。事前面談をぜひご活用ください。
(参考)
医薬品等分野におけるカルタへナ法に基づく申請に対する審査等の状況
- 2019年以降のカルタヘナ法関連承認審査の運用改善(概要)
<2018年以前の運用の課題>- 申請の準備に係る手続きが不明確で、時間がかかる。
- 承認後の変更が困難なため、初回の申請時に必要なデータが多い。
- 申請経験者が少なく、申請情報も少ない。
- カルタヘナ法の相談窓口を明確化(2019年4月)
- 一部変更承認申請のルールを明確化(2021年6月)
- 申請前の申請書案の確認を廃止(2022年2月)
- 申請書・環境影響評価書の記載例や解説書を公開(2021年6月~・随時改訂中)
- 申請前の手続ルールの明確化により、申請準備段階からの総期間を短縮し予見性を確保。 事前の手続きを必要とせず、申請を行うことが可能となった。
- 承認後の変更手続が設定されたため、承認後に得たデータで使用規程の変更が可能に。
- 記載例や解説書の公開により、経験のない申請者でも記載内容や必要な情報が把握可能に。
- 運用手順・審査時間は欧州とほぼ同等に!
- 2019年以降のカルタへナ第一種/第二種申請事務処理期間
第一種 2019年度
(8件)2020年度
(6件)2021年度
(8件)2022年度
(15件)2023年度
(5件)2024年度
(9件)行政側事務処理期間
中央値
(最小値-最大値)
[月]4.7
(2.6-6.6)4.2
(3.6-6.3)3.2
(0.9-4.3)3.3
(1.3-5.3)2.8
(1.1-4.0)3.5
(2.0-4.5)総事務処理期間
中央値
(最小値-最大値)
[月]5.9
(3.2-9.9)6.6
(5.1-10.5)3.5
(0.9-4.9)5.0
(1.3-7.5)3.1
(1.2-7.1)4.2
(2.8-7.2)- 通知上の処理期間:6カ月
- 2019年以降の運用改善により、申請者側の手続きの利便性が向上しており、2021年度には大幅な事務処理期間の改善も認められている。
- COVID-19ワクチンの審査は特例対応により数週間で審査を終えているため集計からは除外。
- 申請者の処理期間について目標値は設定していないため、総事務処理期間は参考値。
- 2018年度以前は運用が大きく異なり比較できないため除外。
第二種 2019年度
(28 件)2020年度
(45 件)2021年度
(50件)2022年度
(18 件)2023年度
(35 件)2024年度
(10 件)行政側事務処理期間
中央値
(最小値-最大値)
[月]0.9
(0.3-1.2)1.1
(0.2-2.1)0.8
(0.2-2.9)1.3
(0.6-2.1)1.4
(0.2-1.5)1.1
(0.5-1.8)総事務処理期間
中央値
(最小値-最大値)
[月]0.9
(0.3-1.2)1.1
(0.2-2.1)0.8
(0.2-4.5)1.5
(0.6-6.2)1.6
(0.2-3.9)1.1
(0.5-2.1)- 通知上の処理期間:3カ月
- 第二種申請は以前から時間はかかっていなかったが、事前の手続きの撤廃により申請者の利便性 が増した。
なお、新規性が高くかつ環境へ影響を与える恐れのある遺伝子組換え生物等は、審査 中に専門家の意見を聴取する可能性がある。 - COVID-19関連の審査は特例対応により数日で審査を終えているため集計からは除外。
- 申請者の処理期間について目標値は設定していないため、総事務処理期間は参考値。
- 参考論文:近年の遺伝子治療用製品等に対する環境影響評価規制の日米欧比較
Japanese Pharmaceutical Regulations of Engineered Viral Vectors for Medical Use Compared with those in the United States and the European Union(外部リンク)
Clin Pharmacol Ther. 2022. doi:10.1002/cpt.2788. PMID: 36404404
第一種使用等(治験・市販)の手続・様式
第一種使用規程承認申請の概要
第一種使用規程の変更申請の概要

(様式)第一種使用規程承認申請(変更申請共通)・変更届
2.1.第一種使用規程承認申請(変更申請共通)
<第一種使用規程承認申請書>
(第一種使用規程承認申請書の記載例)
- アデノ随伴ウイルス(2023年(令和5年)4月版) [41KB]
- アデノウイルス、ヘルペスウイルス(2023年(令和5年)4月版) [49KB]
- レンチウイルス等遺伝子導入細胞(2021年(令和3年)12月版) [28KB]
<生物多様性影響評価書>
(生物多様性影響評価書の記載例)
<第一種変更申請時の追加資料>
2.2.第一種使用規程承認申請書の差換え
2.3.第一種住所等変更届出
対象となる変更手続:氏名及び住所(法人にあたっては、その名称、代表者の指名及び主たる事務所の所在地(カルタへナ法第4条第2項第1号に掲げる事項))
2.4.第一種変更申請後の届出
変更届出書については、変更後の使用等の開始から2週間を目処に厚生労働省医薬局医薬品審査管理課又は医療機器審査管理課に直接提出してください。
2.5.第一種使用等の状況報告等
- 遺伝子組換え生物等状況報告書(2023年(令和5年)6月30日付けQ&A 別紙5) [30KB]
- 遺伝子治療用製品等状況報告書(2023年(令和5年)6月30日付けQ&A 別紙6) [30KB]
- 遺伝子治療用製品等又は遺伝子組換え生物等の評価に影響を及ぼす知見について(2023年(令和5年)6月30日付けQ&A 別紙7) [29KB]
注意:状況報告等はPMDAで受付しておりません。厚生労働省医薬局医薬品審査管理課又は医療機器審査管理課に直接提出してください。
第二種使用等(製造・試験)の手続・様式
第二種使用等拡散防止措置確認申請の概要
(様式)第二種使用等拡散防止措置確認申請・変更届
3.1.第二種使用等拡散防止措置確認申請
<第二種使用等拡散防止措置確認申請書>
(第二種使用等拡散防止措置確認申請書のチェックリスト)
(第二種使用等拡散防止措置確認申請書の記載例)
- 汎用記載例(2024年(令和6年)9月版)[475KB]
- アデノ随伴ウイルス(2024年(令和6年)9月版) [81KB]
- 品質試験のみを行う製造所(2024年(令和6年)9月版) [179KB]
- CAR-T(CAR導入ベクターの製造+CAR-T細胞の製造)(2024年(令和6年)9月版) [79KB]
3.2.第二種使用等拡散防止措置確認申請書の差換え
3.3.第二種住所等変更届出
対象となる第二種住所等変更手続
- 申請者の名称(会社名、大学名、病院名等)、所在地の変更
- 代表者(代表取締役社長、学長、病院長等)の交代に伴う氏名の変更
- 製造所の名称、所在地の変更
3.4.第二種使用等の軽微変更届出
対象となる軽微変更手続については、カルタへナ法Q&A [332KB]の問33, 34をご参照ください。
その上でご質問がある場合は、カルタへナ法関連相談事前面談をお申し込みください。
3.5.第二種使用等の状況報告等
- 遺伝子組換え生物等状況報告書(2023年(令和5年)6月30日付けQ&A 別紙5) [30KB]
- 遺伝子治療用製品等状況報告書(2023年(令和5年)6月30日付けQ&A 別紙6) [30KB]
- 遺伝子治療用製品等又は遺伝子組換え生物等の評価に影響を及ぼす知見について(2023年(令和5年)6月30日付けQ&A 別紙7) [29KB]
注意:状況報告等はPMDAで受付しておりません。厚生労働省医薬局医薬品審査管理課又は医療機器審査管理課に直接提出してください。
カルタへナ申請・変更届のオンライン提出方法
- 2022年12月1日より以下の手続について申請電子データシステム(ゲートウェイシステム)によるオンライン提出が可能になりました。
- なお、オンライン提出を行うためには、事前にゲートウェイシステムへのユーザー登録や電子証明書の取得が必要です。
- 詳しくはゲートウェイシステムのウェブサイトでご確認ください。
【申請電子データシステム(ゲートウェイシステム)ウェブサイト】
URL: https://esg.pmda.go.jp/Ssk/comn001p01.init(外部リンク)
カルタへナ申請・変更届の提出先
【PMDA再生医療製品等審査部宛】
- 第一種使用規程承認申請
- 第一種使用規程変更申請
- 第二種使用等拡散防止措置確認申請
- 第一種住所等変更届出
- 第二種住所等変更届出
- 第二種軽微変更届出
【厚生労働省医薬局医薬品審査管理課長宛】<医薬品、医薬部外品又は化粧品の場合>
- 遺伝子治療用製品等又は遺伝子組換え生物等の評価に影響を及ぼす知見を発見した場合の報告
- 遺伝子組換え生物等の状況報告
- 遺伝子治療用製品等の状況報告
- 第一種使用規程変更届出
【厚生労働省医薬局医療機器審査管理課長宛】<医療機器、体外診断用医薬品又は再生医療等製品の場合>
- 遺伝子治療用製品等又は遺伝子組換え生物等の評価に影響を及ぼす知見を発見した場合の報告
- 遺伝子組換え生物等の状況報告
- 遺伝子治療用製品等の状況報告
- 第一種使用規程変更届出
4.1.カルタへナオンライン申請・変更届の関連通知
様式番号・名称の更新に伴う一部改正通知です。最新の様式は一部改正通知をご確認ください。
カルタへナ関連の法令・通知等
第一種申請等関係
5.1.生物多様性影響評価実施要領(6省共同告示)
5.2.生物多様性影響評価留意事項(局長通知)
- 遺伝子組換え生物等含有医薬品等の第一種使用規程の承認申請に必要な生物多様性影響の評価を実施する際の留意事項について(2007年(平成19年)9月13日 薬食発第0913005号) [167KB]
- 「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律の施行について」等の一部改正について(2013年(平成25年)7月1日 薬食発0701第10号) [50KB]
第二種申請等関係
5.3.産業利用二種省令
最終改正:2022年(令和4年)6月24日財務・厚生労働・農林水産・経済産業・環境省令第2号
5.4.産業利用二種省令(局長通知)
5.5.申請書記載例(事務連絡)
- 遺伝子組換え生物等の第二種使用等に当たって執るべき拡散防止措置が定められていない場合の拡散防止措置の確認に関する申請書の記載例について(2004年(平成16年)7月30日 事務連絡) [1330KB]
5.6.GILSP遺伝子組換え生物等リスト
厚生労働省GILSPリスト
(参考)経済産業省GILSPリスト
最終改正:2023年(令和5年)12月20日経済産業省告示第160号
5.7.GILSP告示の改正について(局長通知)
5.8.輸出入届、製造・終了報告、軽微変更届等
その他(第一種/第二種共通)
【法令】
5.9.カルタへナ法
最終改正:2017年(平成29年)法律第18号(2018年(平成30 年)3月5日施行)
5.10.主務大臣政令
概要:主務大臣を定める政令
5.11.手数料政令
概要:遺伝子組換え生物等に該当すると知らないで輸入する恐れが高い場合に行う生物検査の手数料を定める政令
5.12.カルタへナ法施行規則(6省共同省令)
最終改正:2022年(令和4年)財務省、文部科学省、厚生労働省、農林水産省、経済産業省、環境省令第1号(2022年(令和4年)6月24日施行)
5.13.基本的事項(6省共同告示)
最終改正:2017年(平成29年)財務省、文部科学省、厚生労働省、農林水産省、経済産業省、環境省令第2号(2018年(平成30年)3月5日施行)
【手続関連の通知・事務連絡】
5.14.カルタへナ法Q&A
以下の旧事務連絡は廃止されました。
- 2022年(令和4年)2月3日事務連絡
- 2021年(令和3年)11月25日事務連絡
- 2015年(平成27年)7月16日事務連絡
- 2014年(平成26年)6月30日事務連絡
5.15.オンライン提出通知
- カルタヘナ法に基づく手続のオンライン化について(2022年(令和4年)12月1日 薬生薬審発1201第1号・薬生機審発1201第1号) [350KB]
- 「カルタヘナ法に基づく手続のオンライン化について」の一部改正について(2023年(令和5年)8月29日 薬生薬審発0829第2号・薬生機審発0829第1号) [132KB]
最新の様式番号・名称は2023年(令和5年)8月29日付け一部改正通知に掲載されています。
5.16.手続見直し通知
概要:研究開発二種省令に基づき製造された治験薬等の取扱いに関する見直しが行われました。
- 【旧通知】「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律に基づく手続の見直しについて」の一部改正について(2021年(令和3年)9月30日 薬生発0930第5号) [204KB]
概要:第一種使用規程の承認が必要な時期を治験計画届提出前から治験を開始する日までに変更する見直しが行われました。
概要:第一種使用規程の厚生労働省における審査手続きが審議会での審議事項から報告事項になりました。また、学識経験者としてPMDAを選定する見直しが行われました。
- 旧手続通知(2004年(平成16年)2月19日 薬食発第0219008号)は廃止されました。
5.17.事務取扱通知
概要:申請書等の申請前確認を原則廃止する改正が行われました。
- 旧事務取扱通知(2021年(令和3年)6月4日 薬生薬審発0604第2号・薬生機審発0604第1号)は廃止されました。
5.18.立入検査省令
5.19.輸出表示通知
【参考情報】
5.20.遺伝子組換えウイルスの残存に関する考え方
(参考)旧遺伝子組換えウイルスの残存に関する考え方
遺伝子導入細胞の製造に用いられた非増殖性遺伝子組換えウイルスの残存に関する考え方について(2013年(平成25年)12月16日薬事・食品衛生審議会 生物由来技術部会資料) [89KB]
5.21.ゲノム編集通知Q&A
- 医薬品等におけるゲノム編集技術の利用により得られた生物の取扱いについて(2020年(令和2年)3月23日薬生発0323第1号) [121KB]
- 「医薬品等におけるゲノム編集技術の利用により得られた生物の取扱いについて」に関する質疑応答集(Q&A)について(2021年(令和3年)1月15日 事務連絡) [186KB]
5.22.ウイルス/ベクターを用いた遺伝子治療用製品の排出評価について
(参考)英語版:Evaluation for shedding associated with gene therapy products using viruses/vectors[245KB]
【参考リンク】
5.23.カルタへナ関連英語版HP
5.24.遺伝子治療用製品関連情報
5.25.遺伝子組換え生物等の承認状況に関する情報等
J-BCHは環境省が運営するカルタへナ法関連情報ウェブサイトです。
承認済みの遺伝子組換え生物に関する、第一種使用規程/生物多様性影響評価書、学識経験者の意見(PMDA事前審査結果通知書)を掲載しています。
シンポジウム・学会発表・論文等
シンポジウム・学会発表
6.1.2024年7月15日開催JSGCT教育プログラム2024
6.2.令和5年(2023年)5月22日開催 日本製薬工業協会 バイオ医薬品委員会 技術実務委員会 特別講演会
説明事項
- カルタヘナ法の基礎
- カルタヘナ法の運用改善について
- 実務関連議論
6.3.令和4年(2022年)2月24日開催 日本製薬工業協会 バイオ医薬品委員会 技術実務委員会 特別講演会
説明事項
- カルタヘナ法の基礎
- カルタヘナ法の運用改善について
- 実務関連議論(最新の第一種使用規程審査の考え方、個室管理に係る考え方、家畜伝染病予防法)
- 第二種使用等拡散防止措置確認申請について
参考論文
6.4.近年の遺伝子治療用製品等に対する環境影響評価規制の日米欧比較
Clin Pharmacol Ther. 2022. doi:10.1002/cpt.2788. PMID: 36404404
お問合せ
- 申請書等の提出又は申請等の手続方法に係るご質問は下記メールアドレスにお送りください。
PMDA再生医療製品等審査部
E-mail:cartagena[at]pmda.go.jp(迷惑メール防止対策をしているため、[at]を半角のアットマークに置き換えてください。)
電話番号:03-3506-9471
- なお、申請等の内容に関係する場合はカルタへナ法関連相談事前面談をお申し込みください。
- 申請等の内容に関係するご質問を上記メールアドレスにお送りいただいた場合には、カルタへナ法関連相談事前面談をご案内させていただきます。