後発医薬品変更管理事前確認相談について
1.1.概要
後発医薬品のうち生物学的製剤等を除く、今後一部変更承認申請を行う品目を対象に、事前に変更点に関する評価方針の妥当性やこれまでの変更管理や承認書への記載に関する資料の十分性等について、指導及び助言を行うもの。
1.2.手数料表
| 相談区分 | 手数料額 |
|---|---|
| 後発医薬品変更管理事前確認相談 | 320,000円 |
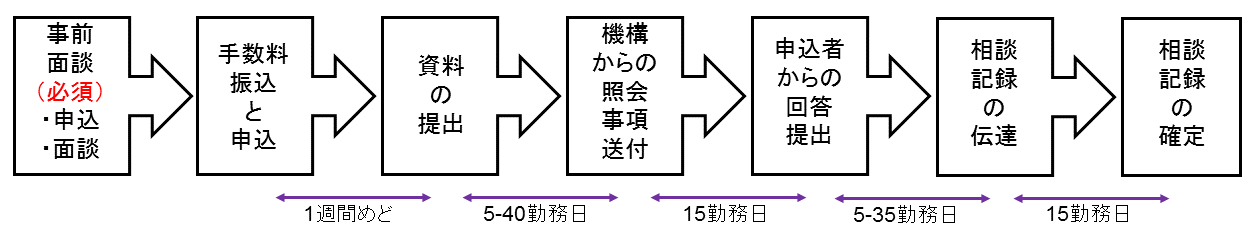
相談の流れ(概要)
注意事項
申込書等に記載される内容、特にご担当者の連絡先(電話番号、FAX番号)に間違いがないことをご確認の上、各種書類を提出くださいますようお願いいたします。
2.1.事前面談(必須)
相談の実施を希望する場合には、相談申込みに先立って事前面談を必ず実施し、機構担当者と以下の点を確認しておいてください。
- 相談事項
- 提出資料の内容
- 相談実施予定時期
- 資料搬入予定時期
- 申込書提出予定日
当該事前面談終了後、機構及び相談者において確認された相談実施予定時期について、後発医薬品変更管理事前確認相談日程確認書を発行します。
なお、本相談の申込時には、事前面談時に発行される後発医薬品変更管理事前確認相談日程確認書が必要となりますので、紛失しないようご注意ください。
事前面談の申込手順等の詳細は、事前面談のWebページをご確認ください。
2.2.手数料振込と申込
手数料を振り込んだ上で、「後発医薬品変更管理事前確認相談申込書」に必要事項を記入するとともに、振込金受領書等の写し及び後発医薬品変更管理事前確認相談日程確認書の写しを添付して原則電子メールによりお申込みください。
申込み先はこちら
各種手数料についてはこちら
受付時期
- 月曜日から金曜日(国民の祝日等の休日を除く)、午前10時~正午(厳守)
様式ダウンロード等
- 様式第4号の3:後発医薬品変更管理事前確認相談申込書
メール提出時のお願い
- 申込書は、テキスト認識可能なファイル(PDF等)で提出してください。
- メールの件名を次のように記載してください。:【申込書】後発医薬品変更管理事前確認相談(会社名)
2.3.資料の提出
実施要綱を参照して作成した相談資料を、申込み後1週間を目途にジェネリック医薬品等審査部へ提出してください。
相談資料の提出に際しては以下の留意事項を必ず事前に確認してください。
2.4.機構からの照会事項送付
相談資料提出から5から40勤務日以内を目途に、機構から相談者に照会事項を送付します。
その際、必要に応じて当該品目の申請に向けた課題等の共通の理解の確認を目的とした面談を実施します。
2.5.申込者からの回答提出
照会事項送付から15勤務日以内を目途に、照会事項に対する回答を提出してください。
回答提出の際には、必要に応じて、面談を実施することも可能です。
2.6.相談記録の伝達
回答提出から5から35勤務日以内を目途に相談記録を作成し、相談者に伝達します。
また、相談記録の伝達から15勤務日以内を目途に必要な修正等を行い、相談記録を確定します。
実施要綱・手数料等関連通知
後発医薬品変更管理事前確認相談についてのお申込み先及びお問合せ先
独立行政法人 医薬品医療機器総合機構 審査マネジメント部 審査マネジメント課
〒100-0013 東京都千代田区霞が関3-3-2 新霞ヶ関ビル
- 電話(ダイヤルイン) : 03-3506-9556
- ファクシミリ : 03-3506-9443
- 電子メール:shinyaku-uketsuke[at]pmda.go.jp([at]を半角のアットマークに置き換えてください。添付ファイルは10MBまでとしてください。1回のメールで送付できない場合は、受付後に担当者に直接送付してください。)
お問合せに関しては、午前9時30分から午後5時まで(土曜日、日曜日及び国民の祝日を除く)となっております。
