新医薬品の事前評価相談について
- 実施要綱等通知はこちら [146KB]
- 医薬品事前評価相談制度の概要はこちら [347KB]
- 2009年度及び2010年度にパイロットプロジェクトとして実施した事前評価相談についてのアンケート調査結果概要はこちらで公表しています。 [383KB]
1.1.相談区分及び概要
事前評価相談を希望する場合、事前評価相談実施依頼書(別紙様式3)を提出してください。実施等の案内を受領後、申込みに先立ち、事前面談(別添16参照)を申し込み、対象品目、事前評価相談の区分、搬入資料の内容、搬入可能時期等について事前の打合せを行ってください。
(1)医薬品事前評価相談(品質)
開発中の品目の品質にかかる申請予定資料(各種試験結果)について、事前に評価を行い、問題点の抽出、課題の整理を行った上で、評価報告書を作成するもの。
(2)医薬品事前評価相談(非臨床:毒性)
開発中の品目の毒性にかかる申請予定資料(各種試験結果)について、事前に評価を行い、問題点の抽出、課題の整理を行った上で、評価報告書を作成するもの。
(3)医薬品事前評価相談(非臨床:薬理)
開発中の品目の薬理にかかる申請予定資料(各種試験結果)について、事前に評価を行い、問題点の抽出、課題の整理を行った上で、評価報告書を作成するもの。
(4)医薬品事前評価相談(非臨床:薬物動態)
開発中の品目の薬物動態にかかる申請予定資料(各種試験結果)について、事前に評価を行い、問題点の抽出、課題の整理を行った上で、評価報告書を作成するもの。
(5)医薬品事前評価相談(第I相試験)
開発中の品目の第I相試験にかかる申請予定資料(各種試験結果)について、事前に評価を行い、問題点の抽出、課題の整理を行った上で、評価報告書を作成するもの。
(6)医薬品事前評価相談(第II相試験)
開発中の品目の第II相試験にかかる申請予定資料(各種試験結果)について、事前に評価を行い、問題点の抽出、課題の整理を行った上で、評価報告書を作成するもの。
(7)医薬品事前評価相談(第II相/第III相試験)
開発中の品目の第II相試験及び第III相試験の一部に係る申請予定資料(各種試験結果)について、事前に評価を行い、問題点の抽出、課題の整理を行った上で、評価報告書を作成するもの。
1.2.手数料表
| 相談区分 | 手数料額 |
|---|---|
| (1)医薬品事前評価相談(品質) | 4,817,600円 |
| (2)医薬品事前評価相談(非臨床:毒性) | 3,256,300円 |
| (3)医薬品事前評価相談(非臨床:薬理) | 3,256,300円 |
| (4)医薬品事前評価相談(非臨床:薬物動態) | 3,256,300円 |
| (5)医薬品事前評価相談(第I相試験) | 5,505,400円 |
| (6)医薬品事前評価相談(第II相試験) | 7,105,200円 |
| (7)医薬品事前評価相談(第II相/第III相試験) | 11,036,500円 |
2025年度 医薬品事前評価相談の受付方法等
医薬品・再生医療等製品事前評価相談実施依頼書の受付方法等について(2025年(令和7年)9月3日 薬機審長発第653号) [156KB]
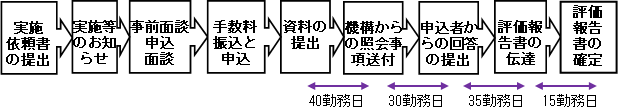
相談の流れ(概要)
注意事項
申込書等に記載される内容、特にご担当者の連絡先(電話番号、ファクシミリ番号、メールアドレス)に間違いがないことをご確認の上、各種書類を提出くださいますようお願いいたします。
3.1.実施依頼
医薬品事前評価相談実施依頼書に必要事項を記入し、電子メールにより提出してください。
【2025年度 受付時期】
実施依頼受付期間:2025年10月6日から10月10日
受付時間:午前9時30分から午後5時(厳守)
提出先はこちら
3.2.実施等のお知らせ
実施等が確定した場合、文書にてお知らせいたします。
3.3.事前面談
事前面談にて、対象品目、事前評価相談の区分、搬入資料の内容、搬入可能時期等について、機構の担当と事前に打合せを行ってください。
事前面談の申込手順等の詳細は、 事前面談のWebページをご確認ください。
3.4.手数料振込と申込
手数料を振り込んだ上で、「医薬品対面助言申込書」に振込金受取書等の写しを添付の上、電子メールによりお申込みください。
3.5.資料の提出
申込み後、相談資料を以下のいずれかにより審査マネジメント部審査マネジメント課へご提出ください。
- 電子媒体1部(CD又はDVD)の郵送又は持参
- 申請電子データシステム(ゲートウェイシステム)を利用したオンライン提出
留意事項
- 相談資料の提出に際しては以下の留意事項を必ず事前に確認してください。
- 相談資料として申請電子データの提出を行う場合は、申請電子データに関するFAQのQ3-33を事前にご確認ください。
提出期限
事前面談で取り決めた期限
3.6.機構からの照会事項送付
資料提出から40勤務日をめどに、機構から相談者に照会事項を送付します。
3.7.申込者からの回答の提出
照会事項送付から30勤務日以内をめどに、照会事項に対する回答を提出してください。
3.8.評価報告書の伝達
回答提出から35勤務日以内をめどに、評価報告書を作成し、相談者に伝達します。また、評価報告書の伝達から15勤務日以内をめどに必要な修正等を行い、評価報告書を確定します。
その際、必要に応じて当該品目の申請に向けた課題等の理解を共有することを目的とした面談を実施します。
実施要綱・手数料等関連通知
新医薬品の事前評価相談についてのお申込み先及びお問合せ先
独立行政法人 医薬品医療機器総合機構 審査マネジメント部 審査マネジメント課
〒100-0013 東京都千代田区霞が関3-3-2 新霞ヶ関ビル
- 電話番号:03-3506-9556
- ファクシミリ番号:03-3506-9443
- 電子メールアドレス:shinyaku-uketsuke [at]pmda.go.jp( [at]を半角のアットマークに置き換えてください。添付ファイルは10MBまでとしてください。1回のメールで送付できない場合は、受付後に担当者に直接送付してください。)
お問合せに関しては、午前9時30分から午後5時まで(土曜日、日曜日及び国民の祝日を除く)となっております。

 [11KB]
[11KB]