抗がん剤併用療法に関する報告書及び審査報告書
注意事項
- 本情報は、抗がん剤併用療法に関する検討会の報告書を踏まえ、各医薬品が承認された時点のものです。当該医薬品の使用に当たっては、最新の添付文書等を併せて読まれるようお願いします。
- 自ら所属する医療機関、薬局等において使用することを目的とする場合を除き、本情報の内容を情報提供者に無断で複製、転載、頒布する等の行為を禁じます。
「審査報告書」について
- 「審査報告書」及び「審議結果報告書」は、当該医薬品の審査経過、評価結果等を取りまとめたものです。 「審査報告書」はPMDAが、「審議結果報告書」は厚生労働省が作成したものであり、承認後、速やかに掲載することとしています。
- 「審査報告書」及び「審議結果報告書」に関するお問い合わせ先は、PMDA審査マネジメント部へお願いします。
「申請資料概要」について
- 「申請資料概要」は、申請資料の最終版を「承認取得者(企業)」が取りまとめたものです。
- 記載された情報に係る権利及び内容の責任は「承認取得者(企業)」に帰属します。
- 「申請資料概要」に関するお問い合わせは、「承認取得者(企業)」へお願いします。
ホームページへの掲載について
- ここに掲げられている「抗がん剤報告書」は、厚生労働省のホームページ上にも掲載されています。
http://www.mhlw.go.jp/shingi/2004/05/s0521-5.html#mokuj
がん剤併用療法に関する報告書について
趣旨
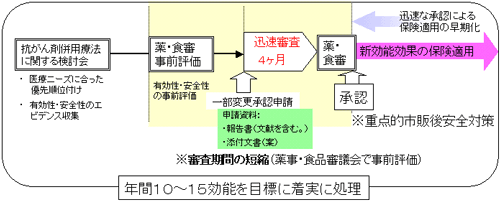
がんの治療法として、学会等でも複数の抗がん剤の併用療法が有効であるとされています。しかしながら、薬事法で承認された抗がん剤であっても、がんの種類等によっては効能が承認されていないため、事実上、併用療法に用いることができない状況にある問題を解決するため、「抗がん剤併用療法に関する検討委員会」を設置し、併用療法に必要な抗がん剤の効能の取得を迅速に進めるものです。
抗がん剤併用療法に関する検討委員会の仕組みについて
- これまで、適応外使用に係る抗がん剤の承認申請については、有効性及び安全性に関するエビデンスの収集などを関係企業の自主的な努力に依存してきましたが、がん治療の社会的な重要性を考え、専門家・業界・行政が共同して参画する「抗がん剤併用療法に関する検討会」を設置したところです。
- 「抗がん剤併用療法に関する検討会」では、効能取得の承認申請促進のための計画を作成し、有効性・安全性等に関するエビデンスの収集を行い、報告書を作成します。
- 薬事・食品衛生審議会において、2.で収集されたエビデンスの事前評価を行い、関係企業に承認申請を促すとともに、事前評価を経た承認申請を迅速(4ヶ月程度)に審査・承認する予定です。
- 承認を取得した抗がん剤については、医療機関等の協力を得ながら、重点的な市販後安全対策を実施します。
公表する報告書
- 平成16年5月21日に開催された薬事・食品衛生審議会医薬品第二部会において、「抗がん剤併用療法に関する検討会」で収集した有効性及び安全性に関する情報(報告書)(資料1~7)が、一定の根拠として適当であるとの評価を受けました。
- 平成16年8月27日に開催された薬事・食品衛生審議会医薬品第二部会において、資料8~15の報告書について、一定の根拠として適当であるとの評価を受けました。
- 平成17年1月21日に開催された薬事・食品衛生審議会医薬品第二部会において、資料16~20の報告書について、一定の根拠として適当であるとの評価を受けました。
ご注意
- 公表された報告書の抗がん剤の併用療法等に関する適応外の効能・効果等は公表時点では承認されたものではなく、その後、関係企業からの効能・効果等の追加に関する一部変更承認申請がなされるべきものであることにご注意ください。
- 公表された報告書の抗がん剤の併用療法等を行う場合には、患者の安全確保を第一に考え、治療に伴い想定される死亡等の重篤な副作用の発生を可能な限り未然に防ぐための適正使用の確保が重要であることから、以下の点に注意するようお願いします。
- 国立・公立がんセンター、特定機能病院、地域がん拠点病院など緊急時に適正な処置が可能であって、がん化学療法に知識・経験を有する医師が在籍する医療機関で使用されるべきものであること。
- 抗がん剤併用療法等に係る抗がん剤の使用上の注意等を熟知し、治療内容や抗がん剤の使用に伴い発生しうる副作用等に関する患者への事前説明と同意の取得に努めるべきものであること。
- 重篤な副作用を知った場合には、遅滞なく関係企業又は厚生労働省に報告すべきものであり、また、抗がん剤併用療法等を実施した場合には、その症例の全数把握に努めるべきものであること。
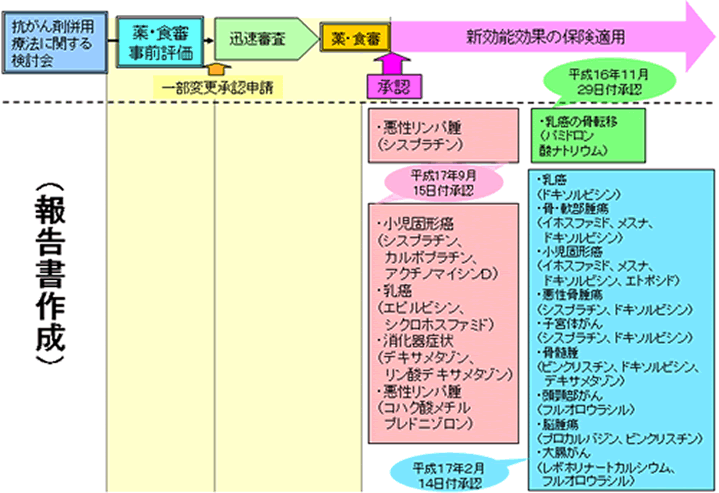
事前評価を受けた報告書に関する承認申請の進捗状況
薬事・食品衛生審議会医薬品第二部会において一定の根拠として適当であると評価を受けた報告書に関して、適応拡大のスキームにおける進捗状況を示しております。(進捗状況)
(平成16年5月21日開催の薬事・食品衛生審議会医薬品第二部会)
- 資料1:ドキソルビシン(
 )(→平成17年2月承認取得)及びシクロホスファミド(乳癌AC療法)(
)(→平成17年2月承認取得)及びシクロホスファミド(乳癌AC療法)( )
) - 資料2:パミドロネート(乳癌)(
 )→平成16年11月承認取得
)→平成16年11月承認取得 - 資料3:イホスファミド(骨・軟部腫瘍)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料4:ドキソルビシン(骨・軟部腫瘍)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料5:ドキソルビシン(小児)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料6:エトポシド(小児)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料7:イホスファミド(小児)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得
(平成16年8月27日開催の薬事・食品衛生審議会医薬品第二部会)
- 資料8:シスプラチン(悪性骨腫瘍)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料9:シスプラチン及びドキソルビシン(子宮体がんAP療法)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料10: シスプラチン(
 )及びメチルプレドニゾロン(悪性リンパ腫)(
)及びメチルプレドニゾロン(悪性リンパ腫)( )
) - 資料11:ビンクリスチン、ドキソルビシン及びデキサメタゾン(骨髄腫VAD療法)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料12:フルオロウラシル(頭頸部がん)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料13:プロカルバジン(脳腫瘍)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料14:ビンクリスチン(脳腫瘍)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得 - 資料15:フルオロウラシル及びアイソボリン(大腸がん)(
 ) →平成17年2月承認取得
) →平成17年2月承認取得
(平成17年1月21日開催の薬事・食品衛生審議会医薬品第二部会)
- 資料16:シスプラチン(小児)(
 ) →平成17年9月承認取得
) →平成17年9月承認取得 - 資料17:カルボプラチン(小児)(
 ) →平成17年9月承認取得
) →平成17年9月承認取得 - 資料18:アクチノマイシンD(小児)(
 ) →平成17年9月承認取得
) →平成17年9月承認取得 - 資料19:エピルビシン(
 )及びシクロホスファミド(乳癌)(
)及びシクロホスファミド(乳癌)( ) →平成17年9月承認取得
) →平成17年9月承認取得 - 資料20:デキサメタゾン及びリン酸デキサメタゾン(抗悪性腫瘍薬投与に伴う消化器症状)(
 ) →平成17年9月承認取得
) →平成17年9月承認取得
抗がん剤併用療法の適応拡大のスキーム
併用療法に係る抗がん剤の適応拡大を早めるため、
- 抗がん剤併用療法に関する検討会の設置
- 適応拡大の優先順位、
- 薬事審査のための有効性・安全性のエビデンスの収集
- 薬事承認審査手続きの迅速化(審議会の事前評価の実施と審査期間の短縮)
抗がん剤併用療法の適応拡大スキーム進捗状況(平成17年9月15日現在)