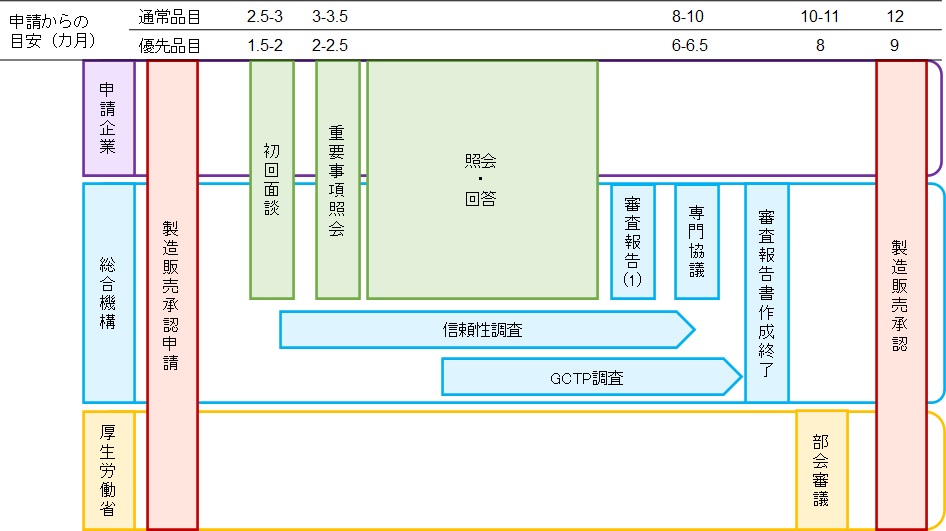
再生医療等製品に係る承認審査のタイムライン
以下のタイムラインは、審査の経験上、特段の問題がなかった場合について、申請受付から総審査期間の目標(通常品目:12カ月、優先品目:9カ月)を達成するよう努力するため、各審査イベントの申請時点からの目安時期を示したものです。
再生医療等製品の審査予定に関する相談
再生医療等製品事前面談にて製造販売承認申請前に審査スケジュール等の確認を行うことができます。相談者が希望する場合には、有料で再生医療等製品事前面談の記録を作成します。
対象製品
平成26年8月12日付け薬食発0812第30号厚生労働省医薬食品局長通知「再生医療等製品の承認申請について」の別表2(1の1)~(6)に該当する再生医療等製品として、製造販売承認申請を予定しているものが対象となります。
事前面談の内容
承認申請予定時期
- 承認申請時に必要な搬入資料の部数及び提出時期(紙申請の場合)
- 標準的なタイムラインに沿った場合の初回面談、重要事項照会、専門協議、目標とする再生医療等製品・生物由来技術部会、承認の予定時期。なお、この段階では、申請資料について精査していないため、審査が支障なく進んだ場合、すなわち標準的なスケジュールを前提としています。製造販売承認申請後、審査の進捗状況によっては予定が変更になる場合もあり、その場合は、その都度申請者に伝えることとします。
- 品質、臨床等、申請後に追加提出する資料の提出時期
GCTP調査に関する確認
- 標準的タイムラインに沿って審査が進んだ場合のGCTP調査に対応できるよう、調査申請の時期、調査の実施時期、バリデーション実施時期などについて確認します。
- GCTP調査申請・調査実施スケジュール等に関する質問については、「新医薬品及び再生医療等製品の承認審査時におけるGMP/GCTP 適合性調査のスケジュールに関する説明及び進捗状況の確認について」を参照してください。
信頼性調査の実施時期及び対象試験
- 海外における承認申請状況及び海外規制当局の査察状況
- 信頼性調査の実施時期及び対象試験
- 国内試験における電磁的記録(電子症例報告書等)の活用状況
- 適合性書面調査及びGCP実地調査に関する調査スケジュール等については、「審査予定に関する事前面談における信頼性保証第一部・第二部からの伝達事項について」を参照してください。
その他の確認事項
- 原薬等登録原簿(マスターファイル)を利用する場合、マスターファイルの登録者の協力が得られることの確認
- 照会事項対応が集中すると予想される時期の共有とその時期に申請者が速やかに対応できることの確認
- 申請電子データを提出する場合、申請電子データの提出範囲等の内容の確認
