2017年11月17日に、厚生労働省は、「医療機器の「臨床試験の試験成績に関する資料」の提出が必要な範囲等に係る取扱い(市販前・市販後を通じた取組みを踏まえた対応)」について通知の発出を行ないました。
医療機器は、改良、改善が頻繁かつ多様な内容で行われる等の特性があるため、それらの特性を活かしつつ、開発をより効率的に行う観点から、「医療機器の迅速かつ的確な承認及び開発に必要な治験ガイダンスのあり方に関する研究」(研究代表者:中野壮陛(公益財団法人医療機器センター専務理事)、平成28 年度日本医療研究開発機構委託研究費(医薬品等規制調和・評価研究事業))において治験に関するガイダンスの検討を行いました。
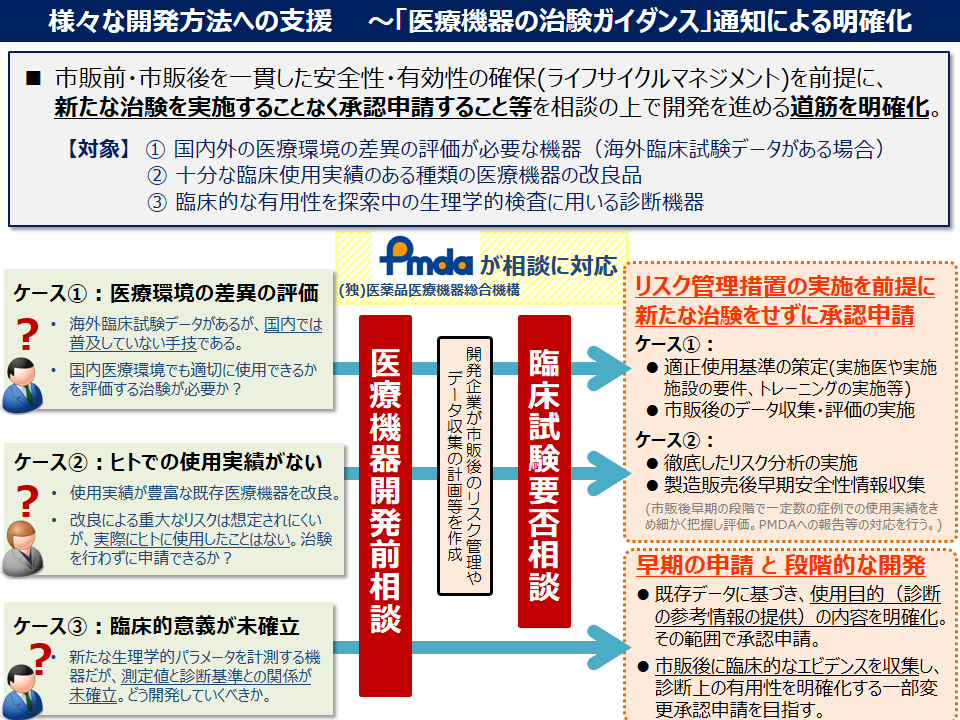
今般、その検討を踏まえて、市販前から市販後まで一貫した安全性及び有効性の確保策を実施することにより、市販前の新たな治験実施の有無によらず、承認申請を行い得ると考えられるケースの取扱いを通知のとおり整理し、運用の明確化を図ることとしました。
PMDAとしても、今後も治験のありかたに係る制度への対応について、厚生労働省とともに取り組んでまいります。
関連通知
関連情報等
- 医療機器の治験ガイダンス通知に関する対面助言
医療機器の治験ガイダンス通知対応に関する各種相談等については、こちらをご覧のうえ、必要となる相談をお申し込み下さい。
医療機器及び体外診断用医薬品の治験相談等の実施要綱はこちら
